Поражения двигательных единиц и мышц
Двигательная единица состоит из мотонейрона α-мотонейрон в спинном мозге или черепно-мозговых нервах), его аксона и всех мышечных волокон, иннервируемых его коллатералями.
Нарушение функции двигательной единицы может быть обусловлено поражением мотонейрона, прерыванием или замедлением аксональной проводимости либо патологией мышцы.
Вирус полиомиелита может инфицировать α-мотонейроны и необратимо разрушать их. Также эти клетки разрушаются при спинальной мышечной атрофии (разнородная группа дегенеративных заболеваний). Генетические дефекты СОД, которая в норме защищает нейроны от окислительного стресса, вызывают боковой амиотрофический склероз. Недостаточная активность СОД приводит к гибели спинальных α-мотонейронов и супраспинальных мотонейронов. Встречаются мутации, которые ведут к дефектам динактина (аксональный транспорт), митохондриальной цитохром с-оксидазы и гена ALSIN (регуляция эндосомного транспорта). При передаваемом по наследству Х-сцепленном синдроме Кеннеди гибель α-мотонейронов происходит из-за дефекта рецепторов андрогенов.
Повреждение или гибель аксонов помимо прочего могут вызывать аутоиммунные заболевания, недостаток витамина В1 или В12, сахарный диабет, интоксикацию (например, свинцом, алкоголем) или генетические дефекты (например, синдром Шарко-Мари-Тута).
Скелетные мышцы могут повреждаться при аутоиммунных заболеваниях (например, дерматомиозите), а также вследствие генетических дефектов, например, при миотонии или дистрофии.
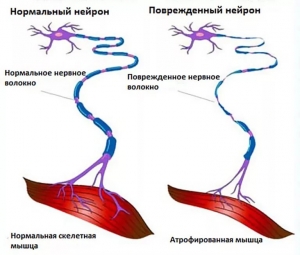
Повреждение двигательной единицы ведет к параличу мышц независимо от того, локализуется ли очаг поражения в α-мотонейроне, аксоне либо в самой мышце. При гибели α-мотонейрона, как правило, наблюдаются фасцикуляции. Они происходят в результате одновременной стимуляции и сокращения мышечных волокон двигательной единицы. При боковом амиотрофическом склерозе разрушение супраспинальных нейронов может приводить к гиперрефлексии и спастичности мышц, пока некоторые α-мотонейроны остаются интактными. Повреждение периферического нерва, при котором уменьшается толщина миелинового слоя, обусловливает снижение скорости проведения импульсов. Чувствительная часть нерва, как правило, тоже поражается. Это сопровождается нарушением чувствительности, а также возникновением спонтанных ПД в поврежденном нерве, что вызывает соответствующие ощущения (парестезии). Если происходит гибель самой мышцы, обычно наблюдаются фибрилляции, т. е. некоординированные сокращения отдельных мышечных волокон.
Генетические дефекты ионных каналов служат причиной развития целой группы функциональных заболеваний мышц. Обычно клеточная мембрана мышечной клетки деполяризуется в ответ на возбуждение потенциалзависимого Na+-канала, что вызывает открытие потенциалзависимого Ca2+-канала и Ca2+-канала саркоплазматического ретикулума. В результате этих процессов внутриклеточная концентрация Ca2+ увеличивается, вызывая мышечное сокращение. Реполяризация достигается путем инактивации Na+-каналов, притока Cl- и выхода К+ из клетки. Это запускает инактивацию Ca2+-каналов, поэтому внутриклеточная концентрация Ca2+ вновь снижается и мышца расслабляется.
Запаздывание инактивации Na+-каналов из-за мутации гена, кодирующего белок ионного канала, может приводить к задержке расслабления мышцы, повышенной возбудимости и судорогам (миотония, связанная с дефектом Na+-каналов, и врожденная парамиотония). Холод способствует замедлению инактивации Na+-каналов, что ведет к судорогам, особенно при парамиотонии. Наличие дополнительного дефекта Na+-канала или дефектного К+-канала может вызывать паралич вследствие высокой внеклеточной концентрации К+ (гиперкалиемический пароксизмальный паралич). Генетический дефект потенциалзависимого Ca2+-канала также приводит к гипокалиемическому пароксизмальному параличу. Дефекты Cl--каналов вызывают миотонию. Эти каналы состоят из нескольких субъединиц. Если включение измененной субъединицы нарушает функцию всего комплекса, такая мутация характеризуется доминантным наследованием (врожденная миотония, болезнь Томсена). Если сама субъединица нефункциональна, но не нарушает функцию интактных субъединиц, мутация характеризуется рецессивным наследованием (миотония Беккера). При определенных дефектах Ca2+-каналов саркоплазматического ретикулума (рианодиновый рецептор) галогенизированные анестетики могут вызывать потенциал-независимую активацию этих каналов с увеличением количества внутриклеточного Ca2+. Это приводит к существенному повышению энергетического обмена и развитию гипертермии (злокачественная гипертермия).
При дегенеративной мышечной дистрофии Дюшенна или Беккера поврежден дистрофии, один из элементов цитоскелета. Ген, кодирующий этот белок, находится на хромосоме X. Это заболевание встречается фактически только у мужчин, т. к. у женщин с одним дефектным геном образуется достаточное количество дистрофина, кодируемого нормальным геном. При дистрофии Дюшенна формируются лишь короткие, совершенно нефункциональные фрагменты дистрофина. Это заболевание заканчивается смертью в течение первых 20 лет жизни. Для этой формы дистрофии типичны выраженный поясничный лордоз позвоночника и гипертрофированные, но, несмотря на это, слабые икроножные мышцы. Вовлечение в патологический процесс кардиомиоцитов приводит к кардиомиопатии. При дистрофии Беккера дистрофин также дефектный, но его функция страдает в меньшей степени, поэтому течение заболевания не столь неблагоприятное, как при дистрофии Дюшенна.
Причиной мышечных дистрофий могут служить дефекты следующих мышечных белков: миотилин, ламин, кавеолин, калпаин, дисферлин, саркогликан, телетонин и титин. Кроме того, миопатии могут быть следствием метаболических дефектов (например, гликогенозов), эндокринных нарушений (например, гипертиреоза) или аутоиммунных заболеваний (например, полимиозита, дерматомиозита).
Диагностика заболеваний/повреждений двигательной единицы
С помощью электромиографии можно отличить первичную миопатию от нейрогенной миопатии.
Для этого в мышцу вводят игольчатый электрод, к коже прикрепляют индифферентный электрод и измеряют разность потенциалов между ними. Поскольку кончик этого внутримышечного электрода почти полностью расположен внеклеточно, измеряется только часть разности потенциалов по обе стороны клеточной мембраны. Амплитуда регистрируемых изменений потенциала зависит от количества одновременно деполяризующихся мышечных волокон рядом с введенным в мышцу электродом.
Поскольку все мышечные волокна, иннервируемые одним α-мотонейроном, деполяризуются одновременно, то чем выше плотность таких волокон возле этого электрода, тем больше амплитуда регистрируемых изменений потенциала. Частота изменений потенциала отражает количество α-мотонейронов, иннервирующих мышечные волокна возле введенного электрода, т. к. разные α-мотонейроны деполяризуются не одновременно.
Волокна, иннервируемые одним α-мотонейроном, обычно в мышце не лежат рядом друг с другом, а распределяются по большой площади поперечного сечения. Количество мышечных волокон возле введенного электрода уменьшается при их разрушении (миогенная миопатия). Это сопровождается снижением амплитуды измеряемых показателей. Если разрушен какой-либо α-мотонейрон (нейрогенная миопатия), не все иннервируемые им мышечные волокна атрофируются, некоторые из них получают иннервацию от коллатералей соседних α-мотонейронов. Двигательные единицы, таким образом, становятся крупнее, как и амплитуда изменений потенциала. Однако частота отклонений снижается, т. к. мышечные волокна рядом с электродом теперь иннервируются меньшим числом двигательных единиц.
Важным показателем наличия и прогрессирования мышечного заболевания служит концентрация в крови креатина, креатинина и креатинкиназы. Креатин образуется в печени и сразу же захватывается здоровыми мышцами. Некоторое количество креатина в мышцах трансформируется в ангидрид креатинина, который, в отличие от креатинина, легко выходит из мышечной клетки через клеточную мембрану и в соответствующем количестве экскретируется почками. Таким образом, количество креатинина, экскретируемого с мочой в единицу времени, пропорционально массе функционирующих мышц. Если в результате мышечной дистрофии мышечная масса уменьшается, экскреция креатинина снижается. При остром разрушении клетки высвобождаются внутриклеточные креатин и креатинкиназа, их концентрация в плазме резко повышается. Если дальнейшего разрушения клеток не происходит, активность креатинкиназы в плазме опускается до нормального уровня, но концентрация креатина может оставаться повышенной, т. к. креатин, образующийся в печени, теперь поглощается меньшим количеством мышц. Продукция креатина также снижается по принципу обратной связи. В результате между плазменной концентрацией или почечной экскрецией креатина и уменьшением мышечной массы строгой закономерности не наблюдается.
