Иммунная система организма человека: свойства, функции, что это, анатомия
Иммунная система организма человека.
Биология иммунной системы
Иммунная система различает «свое» и «чужое» и уничтожает потенциально опасные чужеродные молекулы и клетки из организма. Иммунная система также обладает способностью выявлять и разрушать патологически измененные клетки собственных тканей. Любая молекула, распознаваемая иммунной системой, рассматривается как антиген (АГ).
Кожа, роговица и слизистая оболочка дыхательных путей, желудочно-кишечного тракта образуют физический барьер, являющийся первой линией защиты человеческого тела. Некоторые из этих барьеров обладают активными иммунными функциями:
- Внешний, ороговевший эпидермис: кератиноциты кожи секретируют антимикробные пептиды (дефензины), а сальные и лотовые железы секретируют субстанции, подавляющие микробов. В коже присутствуют многие другие иммунные клетки.
- Слизистая оболочка дыхательных путей, желудочно-кишечного и мочеполового трактов: слизистая оболочка содержит антимикробные вещества, такие как лизоцим, лактоферины и секреторный иммуноглобулин A (SlgA).
При нарушении иммунных барьеров реализуются 2 типа иммунитета: врожденный и приобретенный. Многие молекулярные составляющие участвуют и во врожденном и в приобретенном иммунитете.
Врожденный иммунитет
Врожденный (естественный) иммунитет не требует предварительной встречи с антигенами. Таким образом, он немедленно отвечает на агрессора. Он распознает главным образом молекулы широко представленных антигенов, а не специфичных данному организму или клетке. Его компонентами являются:
- фагоцитирующие клетки,
- антигенпредставляющие клетки,
- естественные клетки-киллеры,
- полиморфно-ядерные лейкоциты.
Фагоцитирующие клетки (нейтрофилы и моноциты крови, макрофаги и дендритические клетки тканей) поглощают и разрушают вторгающиеся АГ Атака фагоцитирующих клеток облегчается, если антигены прикрываются антителами (AT), что является частью приобретенного иммунитета или когда белки комплемента (являющиеся частью менее специфичной врожденной системы защиты) опсонизируют АГ. АГ-презентирующие клетки представляют фрагменты поглощенных АГ Т-лимфоцитам и являются частью приобретенного иммунитета. Естественные клетки-киллеры уничтожают клетки, зараженные вирусом и клетки некоторых опухолей.
Приобретенный иммунитет
Приобретенный иммунитет требует предварительной встречи с антигенами, т.е. ему требуется время для развития после первичной встречи с новым агрессором. Далее следует быстрый ответ. Система запоминает предшествующие контакты и является АГ-специфичной. Ее компонентами являются:
- Т-клетки.
- В клетки.
Приобретенный иммунитет, полученный от определенных Т-клеточных иммунных реакций, называется клеточно-опосредованным иммунитетом. Иммунитет, полученный от В-клеточных реакций, называют гуморальным иммунитетом, т.к. В клетки секретируют растворимые Ag-специфичные антитела. В-клетки и Т-клетки работают вместе, уничтожая инородные элементы. Некоторые из этих клеток не уничтожают инородные элементы напрямую, а вместо этого активируют другие лейкоциты, которые распознают и уничтожают инородные вещества.
Иммунный ответ
Успешная иммунная защита требует активации, регуляции и реализации иммунного ответа.
Активация. Иммунная система активируется чужеродным АГ, который распознается циркулирующими AT или клеточными рецепторами. Эти рецепторы могут быть высокоспецифичными или низкоспецифичными. Низкоспецифичные рецепторы распознают общие группы лигандов, входящих в структуру факторов патогенности микроорганизмов, такие как липополисахариды грамотрицательных бактерий, пептидогликаны грамположительных бактерий, бактериальные флагеллины, неметилированные цитозин-гуанозин динуклеотиды (CpG-мотивы) и вирусные двухполосные ДНК. Активация также возникает, если комплексы АТ-АГ и комплемент-микроорганизм связываются с поверхностными клеточными рецепторами для Fc-фрагмента IgG или для фрагментов комплемента С.
Распознанный АГ, комплексы АГ-АТ или комплемент-микроорганизм подвергаются фагоцитозу. Большинство микроорганизмов уничтожаются в результате фагоцитоза, другие (например, микобактерия) подавляют способность фагоцитов полностью уничтожать их, хотя и не препятствуют поглощению. В таких случаях цитокины, продуцируемые Т-лимфоцитами, в частности IgG, у (ИФН-γ), стимулируют выработку фагоцитами литических ферментов и других микробицидных веществ, которые убивают микроорганизмы.
Пока АГ подвергается быстрому фагоцитозу и полностью разрушается (не частый случай), работает приобретенный иммунный ответ. Он берет начало в селезенке для АГ, циркулирующих в кровотоке, в лимфоузлах для тканевых АГ и в лимфоидных тканях, ассоциированных с слизистой оболочкой (например, миндалевидные железы, аденоиды, Пейеровы бляшки) для АГ слизистой оболочки. Например, дендритные клетки Лангерганса подвергают фагоцитозу антигены в коже и мигрируют в местные лимфоузлы, где производные от АГ пептиды экспрессированы на клеточной поверхности молекул класса II главного комплекса гистосовместимости (МНС), которые представляют пептид CD4 хелперным клеткам (ТН). Когда Т-хелперная клетка работает с комплексом МНС-пептид и получает костимуляторные сигналы, она активируется и экспрессирует рецепторы для ИЛ-2 цитокина и секретирует некоторые цитокины. Каждый набор Т-хелперных клеток секретирует различные комбинации веществ, таким образом, влияя на природу иммунного ответа.
Регуляция. Иммунный ответ должен регулироваться для предотвращения чрезвычайного вреда организму (например, анафилаксия, значительные повреждения тканей). Регуляторные Т-клетки помогают контролю иммунного ответа посредством секреции цитокинов иммуносупрессоров, таких как ИЛ-10 и трансформирующий фактор роста-β (ТФР-β) или же посредством малоизученного механизма клеточного контакта. Данные регуляторные клетки предотвращают возникновение аутоиммунного ответа, и по-видимому, способствуют реализации ответов на несобственные (чужеродные) АГ.
Завершение. Завершение иммунного ответа происходит тогда, когда АГ отделен или удален из организма. Без антигенной стимуляции прекращается секреция цитокинов и активированные цитотоксические клетки подвергаются апоптозу. Апоптоз маркирует клетку для незамедлительно следующего фагоцитоза, препятствующего потере клеточного содержимого и развитию воспаления. Т-клетки и В-клетки, дифференцированные в клетки памяти, избегают данной участи.
Гериатрическая составляющая
С возрастом иммунная система становится менее эффективной, а именно:
- Ослабевает ее способность распознавать собственное от чужеродного, увеличивая частоту аутоиммунных нарушений.
- Макрофаги уничтожают бактерии, раковые клетки и другие АГ менее интенсивно, что объясняет увеличение случаев онкологий среди пожилых людей.
- T-клетки не способны быстро реагировать на АГ.
- Уменьшается количество лимфоцитов, способных реагировать на новые АГ.
- Стареющее тело вырабатывает меньшее количество комплемента в ответ на бактериальные инфекции.
- Меньшее количество AT вырабатывается в ответ на АГ, a AT обладают меньшей способностью прикрепляться к АГ, что объясняет повышение частоты случаев пневмоний, гриппа, инфекционного эндокардита и столбняка и повышенного риска смертельного исхода данных патологий у пожилых. Эти изменения могут также отчасти объяснять неэффективность вакцинаций среди пожилых людей.
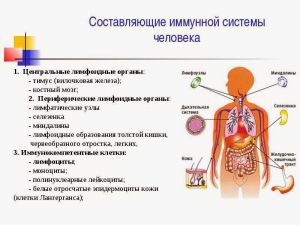
Компоненты иммунной системы
Иммунная система состоит из клеточных и молекулярных компонентов, которые работают совместно с целью уничтожения АГ.
Антигенпрезентирующие клетки
Хотя некоторые антигены могут непосредственно стимулировать иммунный ответ,Т-зависимый приобретенный иммунный ответ обычно требует присутствия АГ-презентирующих клеток (АПК), которые представляют пептиды АГ в комплексе с молекулами МНС. Внутриклеточные АГ (например, вирусные) могут быть преобразованы и представлены рецепторам CD8 Тс-лимфоцитов любыми ядерными клетками. С помощью кодирующих их белков, которые вмешиваются в данный процесс, некоторые вирусы (например, цитомегаловирус) избегают уничтожения. Внутриклеточный АГ должен быть преобразован в пептид и представлен в комплексе с молекулами МНС II класса на поверхности АПК для распознавания клетками хелперами, несущими CD4 клеткам.
Моноциты в кровотоке являются предшественниками тканевых макрофагов. Моноциты мигрируют в ткани, где через 8 ч они развиваются в макрофаги под воздействием колониестимулирующего фактора макрофагов (М-КСФ), секретируемого различными клеточными типами (например, клетками эндотелия, фибробластными клетками).
Макрофаги активируются IFN-y и колониестимулирующим фактором гранулоцитов-макрофагов (ГМ-КСФ). Активированные макрофаги уничтожают внутриклеточные организмы и секретируют ИЛ-1 и фактор некроза опухолей-альфа (TNF-α). Эти цитокины потенцируют секрецию IFN-γ и GM-CSF и увеличивают экспрессию молекул адгезии на поверхности эндотелиоцитов, облегчая приток лейкоцитов к очагу инфекции и разрушение патогенного фактора. В зависимости от профиля экспрессии гена макрофаги были классифицированы в субтипы.
Дендритные клетки присутствуют в коже (клетки Лангерганса), лимфоузлах, в тканях всего организма. Дендритные клетки в коже - пограничные АПК, они захватывают АГ, доставляют его в локальные лимфоузлы, где активируют Т-лимфоциты.
Однако у них есть рецепторы к Fc-фрагменту IgG и комплементу, что позволяет им связывать иммунные комплексы и представлять их В-лимфоцитам зародышевых центров вторичных лимфоидных органов.
Полиморфно-ядерные лейкоциты
Полиморфно-ядерные лейкоциты (ПЯЛ) также называются гранулоцитами, т.к. их цитоплазма содержит специфические гранулы.
Они присутствуют в циркулирующей крови и имеют сегментированное ядро, за исключением тучных клеток, которые постоянно присутствуют в тканях и функционально подобны циркулирующим базофилам.
Нейтрофилы составляют 40-70% всех лейкоцитов; они являются первой линией защиты в борьбе с инфекцией. У зрелых нейтрофилов полупериод существования составляет от 2 до 3 дней. Во время острого воспалительного процесса (например, инфекционного) нейтрофилы, реагируя на хемотаксические факторы, покидают кровяное русло и выходят в ткани. Их цель - фагоцитировать и разрушить патогенные факторы. Микроорганизмы уничтожаются в том случае, когда фагоциты продуцируют литические ферменты и активные формы кислорода (супероксид, гипохлористая кислота) или запускают высвобождение содержимого гранул (дефенсины, протеазы, повышающие проницаемость тканей бактерицидные протеины, лактоферрин и лизоцим). Также высвобождаются ДНК и гистоны, и они вместе с содержимым гранул, таким как эластаза, образуют волокна в окружающих тканях, что может способствовать уничтожению бактерий и локализации ферментной активности.
Эозинофилы составляют около 5% всех лейкоцитов. Они являются щитом от тех организмов, которые слишком велики, чтобы быть поглощенными. Эозинофилы уничтожают такие организмы, секретируя токсические вещества (реактивные соединения кислорода, подобные тем, что продуцируют нейтрофилы), основной щелочной белок (который токсичен для паразитов), эозинофильный катионный белок и некоторые ферменты. Эозинофилы - это также источник медиаторов воспаления (например, простагландинов, лейкотриенов, фактора, активирующего тромбоциты, множества цитокинов).
Базофилы составляют менее 5% лейкоцитов и сходны с тучными клетками, хотя принадлежат к разным клеточным линиям. И те и другие клетки имеют высокоаффинные рецепторы для IgE. Когда эти клетки сталкиваются с определенным АГ, этот АГ перекрестно связывает соседние бивалентные молекулы IgE, что вызывает дегрануляцию клеток с высвобождением готовых медиаторов воспаления и образованием новых медиаторов (лейкотриены, простагландины, тромбоксаны).
Тучные клетки имеются в разных тканях организма. У тучных клеток слизистых оболочек гранулы содержат триптазу и хондроитин сульфат, а если клетка локализована в соединительной ткани, то в ее гранулах содержатся триптаза, химаза, гепарин. При выбросе этих медиаторов формируется защитный острый воспалительный ответ. Дегрануляция может быть запущена анафилатоксином, фрагментами комплемента C3a и C5a.
Цитотоксичные лейкоциты
К цитотоксическим лейкоцитам относятся:
- Естественные клетки-киллеры.
- Лимфокин-активированные киллеры.
Естественные клетки-киллеры (ЕКК). Типичные ЕКК составляют от 5 до 15% моно-нуклеарных клеток периферической крови. Они имеют круглое ядро и гранулированную цитоплазму. ЕКК индуцируют апоптоз в инфицированных и анормальных клетках различными путями. Как клетки врожденного ответа у них отсутствуют антигенспецифичные рецепторы и иммунологическая память.
Типичные ЕКК очень важны при контроле за мутирующими клетками, т.к. они экспрессируют и активирующие и ингибиторные рецепторы. Активирующие рецепторы ЕКК распознают множество лигандов клеток-мишеней (например, относящуюся к МНС класса I цепь A и цепь В. Ингибиторные рецепторы ЕКК распознают молекулы МНС класса I. ЕКК уничтожают свои мишени только при отсутствии сильного сигнала ингибиторных рецепторов. Наличие молекул МНС класса I (в норме экспрессированных на ядросодержащих клетках) на клетках предотвращает их разрушение; а отсутствие указывает на то, что клетка инфицирована каким-то вирусом, ингибирующим экспрессию МНС или что потеряла экспрессию МНС, потому что рак изменил данную клетку. Больные с дефицитом ЕКК особенно чувствительны к герпесной инфекции и человеческому папилломавирусу (вирусу папилломы человека).
ЕКК также секретируют некоторые цитокины; они являются основным источником IFN-γ. Секретируя IFN-γ, ЕКК могут влиять на приобретенную иммунную систему, способствуя дифференциации (дифференцировке) клеток хелперов 1-го типа (Тн1) и ингибируя хелперы 2-го типа (Тн2).
Лимфокин-активированные киллеры (LAK). Некоторые лимфоциты развиваются в очень мощные лимфокин-активированные киллеры (LAK), способные уничтожать широкий спектр опухолевых клеток и аномальных лимфоцитов (например, инфицированные определенными вирусами). Эти клетки не только составляют уникальный клеточный подтип лимфоцитов, они - феноминальны. Предшественники LAK гетерогенны, но изначально могут быть классифицированы как ЕКК-подобные (чаще всего) или Т-лимфоцитоподобные клетки.
Лимфоциты
2 важнейшими типами лимфоцитов являются:
- В-лимфоциты, которые созревают в костном мозге.
- Т-лимфоциты, которые созревают в тимусе.
Они не различаются с точки зрения морфологии, но имеют разные иммунные функции. Они отличаются друг от друга АГ-специфическими поверхностными рецепторами, молекулами, называемыми кластерами дифференцировки (CD), которые присутствуют или отсутствуют в определенном клеточном подтипе. Идентифицировано более 300 CD. Каждый лимфоцит распознает специфический АГ посредством поверхностных рецепторов.
В-лимфоциты. От 5 до 15% лимфоцитов крови - это В-лимфоциты. Они также присутствуют в селезенке, лимфоузлах на слизистой оболочке лимфоидных тканей. В-клетки могут представлять АГ Т-клеткам, но их первоочередной функцией является развитие в клетки плазмы, производящие и секретирующие антитела (AT). Больные с В-клеточными иммунодефицитами (например, Х-связанная агаммаглобулинемия) особенно восприимчивы к рецидивирующим бактериальным инфекциям.
После случайной реаранжировки генов, кодирующих lg, В-лимфоциты способны узнавать практически бесконечное число уникальных АГ. Реаранжировка генов последовательно происходит во время развития В-лимфоцитов в красном костном мозге. Процесс начинается с коммитированной стволовой клетки, проходит стадии про-В- и пре-В-лимфоцитов и завершается незрелым В-лимфоцитом. Если этот незрелый В-лимфоцит взаимодействует с АГ, то может произойти инактивация (развитие толерантности) или элиминация (апоптоз) этой клетки. Незрелые В-лимфоциты, которые не подверглись инактивации или элиминации, могут продолжить развитие до стадии зрелого молодого В-лимфоцита, покинуть красный костный мозг и переместиться в периферические лимфоидные органы, где может произойти их встреча с АГ. Их ответ на АГ происходит в 2 этапа:
- Первичный иммунный ответ. Когда зрелые молодые В-лимфоциты впервые сталкиваются с АГ, эти клетки претерпевают бласттрансформацию, клональную пролиферацию и дифференцировку в клетки памяти, которые отреагируют на такой же АГ в будущем, или в зрелые АТ-продуцирующие плазмоциты. До продукции AT существует латентный период в несколько дней. Потом продуцируются только IgM. Вначале продуцируются только IgM. После взаимодействия с Т-лимфоцитами в В-лимфоцитах может иметь место дальнейшая реаранжировка генов lg, что переключает синтез на IgG, IgA или IgE.
- Вторичный иммунный ответ (анамнестический, усиленный). Когда В-клетки памяти и Т-хелперные клетки повторно встречаются с тем же АГ. В-клетки памяти быстро пролиферируют, дифференцируются в зрелые плазмоциты, быстро синтезируют и выделяют большое количество AT (главным образом IgG, т.к. Т-лимфоциты индуцируют переключение синтеза именно этого изотипа) в кровь и другие ткани, где AT могут реагировать с АГ. Таким образом, после повторной встречи с АГ иммунный ответ более быстрый и эффективный. Т-лимфоциты.
Существует 3 основных типа Т-лимфоцитов:
- Хелперные.
- Регуляторные.
- Цитотоксические.
Более зрелые Т-лимфоциты экспрессируют CD4 или CD8, а также АГ-связывающие lg-подобные рецепторы, называемые Т-клеточными рецепторами (TCR). Гены, кодирующие TCR, подобно иммуноглобулиновым генам, реаранжируются. В результате достигается определенная специфичность и аффинность при контакте с молекулами МНС, представленными на мембране АПК и связанными с пептидами АГ. Число специфичных связей у Т-лимфоцитов практически бесконечно.
Для активации Т-лимфоцита TCR связывается или с комплексом АГ-МНС или со вспомогательными молекулами; в противном случае Т-лимфоцит останется неактивированным или погибнет в результате апоптоза. Некоторые вспомогательные молекулы ингибируют ранее активированные Т-лимфоциты и таким образом завершают иммунный ответ. Полиморфизм гена CTLA-4 ассоциирован с некоторыми аутоиммунными патологиями.
Т-Хелперными (Тн) клетками обычно являются CD4, но могут быть и CD8. Они дифференцируются из Тн0-клеток в одни из следующих:
- Тн1-клетки: В общем Тн1-клетки способствуют клеточно-опосредованному иммунитету посредством цитотоксических Т-лимфоцитов и макрофагов, таким образом играя особую роль в защите против внутриклеточных патогенов (например, вирусных),
- Тн2-клетки: Тн2-клетки способствуют продукции AT В-клетками (гуморальный иммунитет), таки образом участвуя в ответах, направленных на определенные внеклеточные патогены (например, бактерии, паразиты).
- Тн17-клетки: Тн17-клетки способствуют тканевых воспалениям.
Каждый тип клеток секретирует определенные цитокины. Имеются различные общие схемы продукции цитокинов, которые и определяют для Тн-клеточные функциональные фенотипы. Тн2-клетки способны до определенного уровня регулировать в сторону понижения функциональную активность друг друга, что приводит к доминированию Тн1- или Тн2-ответа.
Различие между разными типами β-клетками клинически достоверно. Например, Тн1-ответ преобладает при туберкулоидной лепре, а Тн2-ответ преобладает при лепроматозной лепре. Тн1-ответ характерен для некоторых аутоиммунных патологий, а Тн2-ответ способствует продукции IgG и развитию аллергических заболеваний, а также помогает В-клеткам секретировать антитела при некоторых аутоиммунных патологиях (например, болезнь Грейвса, миастения гравис). Для больных с иммунодефицитными состояниями характерны дефективные Тн 17-клетки (например, синдром гипер IgE [Job]),такие больные наиболее восприимчивы к инфекциям, вызванным Candida albicans и Staphylococcus aureus.
Регуляторные Т-клетки. Опосредуют супрессию иммунных ответов и обычно экспрессируют фактор транскрипции Fox3. В данном процессе участвуют профессиональные клеточные подсемейства CD4 CD8, они либо секретируют цитокины, обладающие иммуносупрессивными свойствами, либо подавляют иммунный ответ, механизм подавления пока плохо изучен и требует прямого контакта между клетками. У больных с функциональными мутациями в Foxp3 развиваются аутоиммунная патология, синдром IPEX (иммунодисрегуляция, полиэндокринопатия, энтеропатия, Х-связанная).
Цитотоксическими Т(Тс)-клетками, как правило, являются CD8, но могут быть и CD4; они необходимы для уничтожения внутриклеточных патогенов, в частности, вирусов.
Тс-клетки проходят 3 стадии развития:
- Клетка-предшественник, которая при соответствующей стимуляции дифференцирует в Тс-клетку.
- Дифференцированная клетка-эффектор, способная уничтожать мишени.
- Клетка памяти, находящаяся в покое (уже не стимулированная), но готовая выполнять эффекторную функцию после повторной стимуляции оригинальным сочетанием АГ-МНС.
Полностью активированные Тс клетки, подобно ЕКК, способны уничтожать инфицированную клетку-мишень, индуцируя апоптоз.
Тс клетки могут быть:
- Изогенными: произведенными в ответ на собственные (аутологичные) клетки, модифицированные вирусной инфекцией или другими чужеродными белками.
- Аллогенными: произведенными в ответ на клетки, экспрессирующие чужеродные продукты МНС (например, при органных трансплантациях когда молекулы донорского МНС отличаются от МНС реципиента) Некоторые Тс-клетки могут направленно распознавать чужеродные МНС (прямой путь); другие могут распознавать фрагменты чужеродного МНС, представленные собственными молекулами МНС реципиента трансплантата (непрямой путь).
Антитела
AT функционируют как антигенный рецептор на поверхности В-клеток и в ответ на АГ секретируются плазмоцитами. AT распознают специфические конфигурации на поверхности АГ (например, белки, полисахариды, нуклиновые кислоты). AT и АГ точно подходят друг другу, поскольку их формы и другие поверхностные свойства (например, нагрузка) комплементарны. Одна и та же молекула AT может перекрестно реагировать с соответствующим АГ, если их эптопы достаточно схожи с эпитопами исходного АГ.
Структура. AT состоят из 4 полипептидных цепей (2 идентичных тяжелых цепей и 2 идентичных легких цепей), связанных дисульфидными связями для производства Y конфигурации. И тяжелая и легкая цепи имеют варабильный (V) и константный (С) участки.
V - Вариабельные участки располагаются на аминотерминальных концах верхней части Y; они называются вариабельными, потому что содержат различные аминокислоты, которые и определяют специфичность lg. Гипервариабельные регионы содержат идиотипические детерминанты, с которыми связываются определенные естественные (антиидиотипические) AT; эта связь может помочь в регуляции В-гуморального ответа. В-лимфоциты могут изменять изотип тяжелой цепи продуцируемого lg, но сохраняет тяжелые цепи V-региона и полностью легкую цепь, в связи с чем сохраняется АГ-специфичность.
С-регион состоит из относительно постоянной последовательности аминокислот, которая характерна для каждого lg-изотипа.
Аминотерминальный (вариабильный) конец AT связывается с АГ и формирует комплекс АГАТ. АГ-связывающая часть lg (Fab) состоит из легкой цепи и фрагмента тяжелой и включает V-регион молекулы lg (смешанная часть).
Классы антител. Антитела подразделяются на 5 классов:
- IgM,
- IgG,
- IgA.
- IgD,
- IgE.
Данные классы различаются по типу тяжелой цепи; существует также 2 типа легких цепей (к и А). Все 5 классов lg имеют либо к- либо λ-легкие цепи.
IgM является первым AT, которое формируется после встречи с новым АГ. Он состоит из 5 Y-молекул (10 тяжелых и 10 легких цепей), связанных простой связью. IgM циркулирует преимущественно во внутрисосудистом пространстве; он связывается и агглютинирует АГ и может активировать комплемент, что облегчает фагоцитоз. IgM представляют собой изо гемагглютинины и многие AT к грамотрицательным микроорганизмам. Мономер IgM является АГ-рецептором на поверхности В-лимфоцитов. У больных с синдромом гипер-lgM имеется дефект генов, участвующих во включении конкретного класса антител (например, генов, кодирующих CD40 или CD154); поэтому уровни IgA, IgM и IgE у них низкие или вовсе отсутствуют, а уровни циркулирующих IgM зачастую высоки.
IgG преобладающий изотип lg; он циркулирует и во внутри- и во внесосудистом пространствах. IgG - первично циркулирующий lg, появляющийся после реиммунизации (при вторичном иммунном ответе) и являющийся доминантным изотипом в коммерческой у глобулиновой продукции. IgG защищает организм от бактерий, вирусов,токсинов, и это единственный изотип lg, который проходит через плацентарный барьер. Вот почему данный класс антител важен как протектор новорожденных, но пато генные IgG антитела, в случае присутствия в организме будущей матери могут спровоцировать серьезное патологическое состояние плода.
Выделяют 4 субкласса IgG: IgG1, LgG2, lgG3, lgG4, пронумерованные по убыванию концентрации IgG в сыворотке. Субклассы IgG отличаются главным образом по их способности активировать комплемент; IgG1 и LgG3 наиболее эффективны, lgG2 менее эффективен и LgG4 неэффективен. IgG1 и IgG3 являются эффективными медиаторами клеточной цитотоксичности, опосредованной антителами; lgG4 и lgG2 менее эффективны в этом плане.
IgA присутствует на поверхностях слизистых оболочек, в сыворотке и в секретах (слюна, слезная жидкость, секрет респираторного, желудочно-кишечного и мочеполового трактов, молозиво), где обеспечивает начальную антибактериальную и антивирусную защиту. J-цепь связывает IgA в димер - формируется молекула секреторного IgA. Секреторный IgA синтезируется плазмацитами в субэпителиальной части слизистой оболочки ЖКТ и дыхательных путей. Избирательный дефицит IgA относительно распространен, но не имеет большого значения с точки зрения клиницистов, поскольку существует перекрестная функциональность между другими классами антител.
IgD коэкспрессирован с IgM на поверхности молодых В-лимфоцитов. Имеют ли эти 2 класса различные функции, и если да, то насколько -пока неясно. Они могут быть просто примером молекулярной деградации. Уровни IgD в сыворотке очень низки, а функция циркулирующего IgD неизвестна.
IgE присутствует в низкой концентрации в сыворотке и в слизистом секрете дыхательных путей и ЖКТ. IgE с высокой степенью аффинности связывается с FcsRI-рецепторами, в большом количестве находящимися на поверхности тучных клеток и базофилов и в небольшом количестве - на поверхности некоторых гемопоэтических клеток, в т.ч. дендритических. Если аллерген связывает 2 молекулы IgE, присоединенные к поверхностям базофилов или тучных клеток, то эти клетки дегранулируют, выделяя медиаторы аллергической реакции. Уровень IgE повышается при атопических поражениях (атопическая и экзогенная астма, сенная лихорадка, атопический дерматит) и паразитарных инфекциях.
Реактанты острой фазы
Реактанты острой фазы - белки плазмы, уровень которых резко повышается или в некоторых случаях понижается при инфекционных процессах или поражении тканей. Наиболее значительно повышается С-реактивный белок и маннозосвязывающий лектин (который фиксирует белки комплемента и играет роль опсонина), α1-транспортный белок кислого гликопротеина и сывороточный компонент амилоида СРВ и СОЭ часто измеряются; повышение уровней является неспецифическим признаком инфекции или воспаления. Повышенный фибриноген является главной причиной повышения ESR.
Многие реактанты острой фазы вырабатываются в печени. В совокупности они помогают ограничивать повреждение тканей, повышают резистентность организма к инфекциям, способствуют репарации тканей и прекращению воспаления.
Цитокины
Цитокины - это полипептиды, секретируемые иммунными и другими клетками после их взаимодействия со специфическим АГ, эндотоксином и другими цитокинами. Основные группы цитокинов включают интерфероны:
- интерфероны;
- факторы некроза опухолей (TNF-α, лимфотоксины-α,лимфотоксины-β);
- интерлейкины (IL);
- хемокины;
- трансформирующие факторы роста;
- гемопоэтические колониестимулирующие факторы (CSF).
Хотя лимфоцит начинает секрецию цитокина после взаимодействия со специфическим АГ, сами по себе цитокины не являются АГ-специфическими.
Цитокины передают сигналы через рецепторы клеточной поверхности. Например, рецептор И/1-2 состоит из 3 цепей: α, β и γ. Аффинность рецептора для ИЛ-2 будет высокой, если экс-прессированы все 3 цепи, средней, если экс-прессированы только β- и γ-цепи, и низкой, если экспрессирована только α-цепь. Мутации либо делеции уцепи составляют основу Х-цепленного тяжелого комбинированного иммунодефицита.
Хемокины индуцируют хемотаксис и миграцию лейкоцитов. Выделяют 4 субсемейства, отличающихся количеством разделяющих аминокислот между первыми двумя цистеиновыми остатками. Хемокиновые рецепторы (CCR5 на Т-лимфоцитах памяти, моноцитах/макрофагах, дендритических клетках; CXCR4 на остальных Т-лимфоцитах) являются корецепторами для проникновения ВИЧ (вируса иммунодефицита человека) в клетку.
Лейкоцитарные антигены человека
Система лейкоцитарных антигенов человека (HLA) локализуется в 6-й хромосоме. Эта хромосома кодирует молекулы клеточной поверхности.
Молекулы МНС класса I присутствуют на поверхности всех ядерных клеток в качестве трансмембранных гликопротеинов; после того как данные молекулы денатурируются и расщепляются, их поглощают тромбоциты. Нормальная молекула класса I состоит из тяжелой цепи а, связанной с р2-молекулой микроглобулина. Тяжелая цепь состоит из двух связанных пептидных доменов, lg-подобного домена, трансмембранного участка и цитоплазматического конца. Тяжелая цепь молекулы МНС I класса кодируется генами HLA-A, -В или С-локусов. Лимфоциты, реагирующие на молекулы МНС I класса, экс-прессируют молекулы CD8 и выполняют эффекторные функции, заключающиеся в способности распознавать любые инфицированные клетки. Поскольку любая ядросодержащая клетка экс-прессирует молекулы МНС класса I, все инфицированные клетки являются антигенпрезентирующими для CD8 положительных Т лифоцитов (CD8 связывается с неполиморфным участком тяжелой цепи класса I). Некоторые гены МНС класса I кодируют неклассические МНС-молекулы, например HLA-G и HLA-E (которые представляют пептиды некоторым рецепторам ЕКК).
Молекулы МНС класса II обычно представлены только на профессиональных АГ-презентирующих клетках, эпителиальных клетках тимуса и активированных (но не покоящихся) Т-клетках; большинство ядросодержащих клеток могут быть стимулированы для экспрессии молекул МНС класса II интерфероном (IFN)-γ. Молекулы МНС класса I состоят из двух полипетидных (а и (3) цепей; у каждого пептида имеется пептид-связывающий участок, lg-подобный участок и трансмембранный регион с цитоплазматическим хвостиком. Обе полипептидные цепи кодируются генами регионов HLA-DP, -DQ, or -DR 6-й хромосомы. Лифоциты, реагирующие на молекулы МНС класса II, экспрессируют CD4 и часто являются Т-клетками-хелперами.
Регион МНС класса III кодирует некоторые молекулы, значимые при воспалении.
Отдельные определенные с помощью серологического типирования антигены, кодируемые генами локусов класса I и II, имеют стандартные обозначения. Аллели, определенные с помощью ДНК-секвенирования, содержат в обозначении название гена, далее идет звездочка, потом цифры, обозначающие аллельную группу (часто соответствующую серологически выявленному антигену, кодируемому данным аллелем), потом - двоеточие и цифры, обозначающие данный аллель. Иногда в обозначении аллеля имеются после двоеточия дополнительные цифры для обозначения аллельных вариантов, кодирующих идентичные белки, и после второго двоеточия добавлены цифры для обозначения полиморфизмов в интронах или же в 5' или 3' нетранслируемых регионах.
Молекулы МНС класса I и II являются самыми иммуногенными антигенами и распознаются в процессе отторжения аллогенного трансплантата. Сильнейшей детерминантой является HLA-DR, затем идут HLA-B и -А.Три данные локуса поэтому и являются важнейшими при подборе подходящего (тканесовместимого) донора реципиенту.
Система комплемента
Система комплемента - каскад ферментов, облегчающих борьбу с инфекционным процессом. Эта система связывает врожденный и приобретенный иммунитет путем:
- Увеличения ответа антител (AT) и иммунологической памяти.
- Лизинга чужеродных молекул.
- Удаления иммунных комплексов. Компоненты системы комплемента выполняют множество биологических функций.
Активация белков комплемента: существует 3 пути активации комплемента:
- классический,
- лектиновый (маннозосвязывающий лектин-MBL),
- альтернативный.
Компоненты классического пути обозначаются буквой С и цифрой, обозначающей очередность их идентификации. Компоненты альтернативного пути часто обозначаются буквенно (например, фактор В, фактор D) или отдельным названием (например, пропердин).
Классический путь. Активация классического пути - АТ-зависимый процесс, который начинается после взаимодействия С1 с комплексом АГ-lgM или АГ-lgG, или АТ-независимый процесс, когда полианионы (гепарин, протамин, ДНК или РНК апоптотических клеток), грамотрицательные бактерии или связанный С-реактивный белок реагируют непосредственно с С1. Этот путь регулируется С1-ингибитором (C1-INM). Наследственная ангиоэдема ассоциирована с генетической недостаточностью C1-INH.
Лектиновый путь (маннозосвязывающий лектин) - АТ-независимый процесс; он начинается, когда MBL-сывороточный белок связывается с маннозой, фруктозой.
Альтернативный путь начинается с прилипания компонентов микробной клеточной поверхности или lg к небольшому количеству С3. Этот путь регулируется пропердином, фактором Н, фактором, ускоряющим некроз.
Эти 3 пути в конце концов сходятся в одну точку, когда С3-конвертаза превращает С3 в С3a и С3b. Расщепление С3 может привести к образованию комплекса атаки на мембрану (MAC), цитотоксическому компоненту системы комлпемента. MAC является причиной лизиса чужеродных клеток.
Больные с дефицитом компонентов комплемента часто подвержены рецидивирующим бактериальным инфекциям, в частности при отсутствии компонента С3. Дефекты С1 и С4 ассоциированы с системной красной волчанкой.
Биологическая активность. Компоненты системы комплемента выполняют и другие биологические функции, которые реализуются рецепторами комплемента (CR) на различных типах клеток.
- CR1 (CD35) способствует фагоцитозу и участвует в выведении иммунных комплексов.
- CR2 (CD21) регулирует продукцию AT В-лимфоцитами и является рецептором вируса Эпштейна - Барр.
- CR3 (CDllb/CD18), SR4(CDllc/CD18) и рецепторы Clq играют роль в фагоцитозе.
- С3а, С5а и С4а (слабо) проявляют анафилатическую активность. Они вызывают дегрануляцию тучных клеток, ведущую к повышению проницаемости сосудов и сокращению гладкой мускулатуры.
- С3b работает в качестве опсонина покрывая микроорганизмы и тем самым усиливая их фагоцитоз.
- C3d усиливает продукцию AT В-лимфоцитами.
- С5а является хемоэттрактантом нейтрофилов.Он контролирует активность нейтрофилов и моноцитов и может стать причиной повышенного слипания клеток, дегрануляции и высвобождения внутриклеточных ферментов из гранулоцитов, продукцию токсических метаболитов кислорода и другие действия, связанные с клеточным мета болизмом.
