Яичники: строение, функции, норма, нормальные размеры, структура
В яичниках образуются яйцеклетки и вырабатываются женские половые гормоны.
Быстрый рост одного из фолликулов, овуляция, рост, овуляция — и так месяц за месяцем, в течение в среднем 38 лет. Постоянство этого процесса не может не вызывать восхищения. Регулярность, предсказуемость, периодичность и спонтанность овуляторного менструального цикла поддерживаются сложными взаимодействиями между гипоталамо-гипофизарной системой, яичниками и половыми путями. Циклический характер женской репродуктивной функции обусловлен способностью яичника к структурным и функциональным изменениям. Выработка стероидных гормонов, а также местных факторов, влияющих на рост фолликулов вместе с гонадотропными гормонами, происходит в разных отделах яичника. Эстрогены и прогестагены, основные стероидные гормоны, секретируемые яичниками, способствуют росту и развитию матки, маточных труб, влагалища и обеспечивают половое развитие.
Нарушение этого процесса может приводить к дисфункции яичников, преждевременному половому развитию или его задержке, нарушениям менструального цикла, гиперандрогении и бесплодию. С возрастом находящиеся в яичниках фолликулы подвергаются атрезии, и к 50 годам их остается совсем немного. Уровень эстрогенов снижается, что приводит к наступлению менопаузы.
Внутриутробное развитие
Закладка половых желез происходит в самом начале эмбрионального развития. Первичные гонады у эмбрионов обоих полов никак не различаются. Их можно выявить уже на 1-м месяце эмбрионального развития.
Яичник образуется из трех основных типов клеток:
- целомического эпителия полового тяжа, который позднее дифференцируется в гранулезные клетки;
- мезенхимы полового тяжа, из которой образуется строма яичника;
- первичных половых клеток, которые дифференцируются из энтодермы желточного мешка и дают начало яйцеклеткам.
На 3-й неделе внутриутробного развития из энтодермы желточного мешка, расположенного на каудальном конце эмбриона, дифференцируются первичные половые клетки. На 6-й неделе первичные половые клетки перемещаются в подлежащую мезенхиму и встраиваются в половые тяжи. Высокая активность ЩФ этих клеток позволяет проследить их путь с помощью цитохимических методов. Механизм амебовидного перемещения первичных половых клеток в половые тяжи до конца не ясен. Предполагают, что в регуляции этого процесса играют роль факторы хемотаксиса, вырабатываемые первичными гонадами. Одновременно с перемещением происходит пролиферация первичных половых клеток. К 5-й неделе у эмбриона насчитывается примерно 1000 первичных половых клеток, а к 8-й неделе их количество может достигать 600 тысяч.
У эмбриона женского пола во время перемещения первичных половых клеток к половым тяжам одна из Х-хромосом инактивируется. Инактивация одной Х-хромосомы позволяет избежать анеуплодии. Для нормального развития яичника необходимы две Х-хромосомы. При кариотипе 45,X первичные половые клетки мигрируют в гонады, но развитие фолликулов замедлено, а атрезия происходит так быстро, что к моменту рождения на месте яичников остаются лишь соединительнотканные тяжи.
Характерную гистологическую структуру яичника можно увидеть лишь к 10—11-й неделе внутриутробного развития, тогда как яички дифференцируются несколько раньше. В половых железах первичные половые клетки продолжают делиться путем митоза. К 20-й неделе эмбриогенеза число оогониев достигает максимума — 6—7 млн. Созревание фолликулов продолжается во второй половине внутриутробного развития через стадию третичного фолликула к ат-резии. Ббльшая часть половых клеток погибает внутриутробно, и к моменту рождения в яичниках остается всего 1 млн половых клеток. Созревание и атрезия фолликулов происходят в течение всего детородного периода.
Недавние исследования показали, что оогонии могут пролиферировать в яичнике и после рождения, но клиническое значение этих данных неясно. В начале эмбрионального периода яичник лежит в непосредственной близости от первичной почки. Первичная почка оказывает воздействие на дифференцировку и мужских, и женских половых желез и необходима на заключительной стадии развития яичника. Взаимодействие между яичником и первичной почкой формируется в начале дифференцировки яичника, но со временем ткани первичной почки постепенно рассасываются. У человека клетки первичной почки внедряются в яичник и образуют его мозговое вещество. Это способствует смещению половых клеток в корковое вещество яичника. Оогонии делятся путем митоза, затем — на 12-й неделе эмбриогенеза — они дифференцируются в ооциты I порядка и вступают в мейоз. Однако в конце диплотены процесс останавливается и возобновляется только перед овуляцией.
Второе деление мейоза происходит после оплодотворения. Остановка мейоза, вероятно, регулируется фактором, вырабатывающимся в самом яичнике — ингибитором созревания ооцитов. После остановки мейоза вокруг ооцита I порядка образуется слой гранулезных клеток, в результате чего возникает примордиальный фолликул — морфологический признак дифференцировки яичников у плода. От окружающей стромы яичника фолликул отделен базальной мембраной. Перед овуляцией мейоз возобновляется под действием активирующих стеролов.
Превращение оогониев в ооциты I порядка и последующее формирование примордиальных фолликулов продолжается и в первые 6 мес после рождения. Ооциты, из которых не образуются фолликулы, разрушаются, чем и объясняется тот факт, что к моменту рождения большинство ооцитов исчезает. Вначале примордиальные фолликулы располагаются в глубине коркового вещества, на границе с мозговым веществом яичника. Роль гонадотропных гормонов в развитии яичников показана при исследовании плодов с анэнцефалией и в опытах по гипофизэктомии у плодов обезьян — у тех и других развитие фолликулов нарушалось.
Как показывают исследования in vivo и in vitro, к 8-й неделе внутриутробного развития яичники почти не вырабатывают стероидных гормонов.
Яичники девочки
Масса яичника новорожденной девочки составляет в среднем 250 мг, а к менархе достигает в среднем 4 г. Рост яичников происходит благодаря увеличению количества стромы, числа фолликулов и их размера. Созревание фолликулов завершается в пубертатном периоде под действием гонадотропных гормонов. Основные гормоны, регулирующие развитие фолликулов и овуляцию — это ФСГ и ЛГ.
Уровни гонадотропных гормонов существенно различаются в разные периоды жизни женщины. Гипоталамус, гипофиз и яичники плода, новорожденной и девочки в препубертатном периоде функционируют и способны к выработке гормонов. Во II триместре беременности уровень гонадотропных гормонов в плазме плода становится почти таким же высоким, как в постменопаузе. Подъем уровня гормонов у плода связан с максимальным развитием фолликулов. Кроме того, в этот период завершается созревание гипоталамо-гипофизарной системы, и она становится более чувствительной к высокому уровню стероидных гормонов, секретируе-мых плацентой. Под действием этих гормонов уровни ФСГ и ЛГ незадолго до родов снижаются. После пересечения пуповины уровни эстрогенов и прогестерона в крови новорожденной девочки резко падают, и в результате уровни гонадотропных гормонов резко возрастают. Уровень гонадотропных гормонов остается высоким в течение нескольких месяцев, снижаясь к 1—3 годам. Низкий уровень гонадотропных гормонов у ребенка объясняется повышенной чувствительностью гипоталамо-гипофизарной системы к небольшим количествам половых гормонов, циркулирующих в крови. По некоторым данным, у здоровых детей чувствительность гипоталамо-гипофизарной системы к угнетающему действию эстрогенов намного выше, чем у взрослых. В снижении уровня гонадотропных гормонов у детей важную роль играет ЦНС, о чем свидетельствует снижение уровня ЛГ и ФСГ у детей в возрасте 5—11 лет с дисгенезией гонад. Способность гонадолиберина повышать уровень гонадотропных гормонов у детей с дисгенезией гонад указывает на выработку в ЦНС некоего нестероидного вещества, подавляющего активность гипоталамо-гипофизарной системы. Однако на сегодняшний день естественный ингибитор гонадолиберина у человека и приматов не найден.
Несмотря на то, что базальные уровни гонадотропных гормонов у девочек низкие, небольшие выбросы с интервалом 2—3 ч все же регистрируются.
Уровни андростендиона, дегидроэпиандростерона и дегидроэпиандростерона сульфата начинают расти примерно с 6—8 лет. Повышение уровней надпочечниковых андрогенов можно отчасти объяснить снижением синтеза 3β-гидро-ксистероидцегидрогеназы в сетчатой зоне коры надпочечников у детей старше 5 лет. Это усиление секреции надпочечниковых андрогенов называется адренархе и, по-видимому, не регулируется АКТГ. На роль вещества, стимулирующего выработку андрогенов корой надпочечников, был предложен ряд других пептидных и белковых гормонов, но окончательно этот вопрос еще не решен. Надпочечниковые андрогены довольно слабые, но способны превращаться в тканях-мишенях в более мощные тестостерон и дигидротестостерон, которые и оказывают свое действие на органы, содержащие рецепторы этих гормонов.
Возможно, что именно надпочечниковые андрогены и их метаболиты запускают ускорение роста в начале пубертатного периода. Они же вызывают подмышечное и лобковое оволосение. Поскольку вскоре после адренархе усиливается секреция гонадолиберина, некоторые специалисты склонны считать, что адренархе — важное условие для созревания гипоталамо-гипофизарной системы. Между тем существуют веские данные в пользу того, что эти два события запускаются и регулируются независимо одно от другого. У девочек с первичной аменореей, обусловленной патологией гипоталамуса (например, с синдромом Кальмана) или первичным гипогонадизмом (например, дисгенезией гонад) адренархе, как правило, наступает, но секреция гонадолиберина не усиливается. Преждевременное адренархе (пубархе) характеризуется появлением подмышечного и лобкового оволосения у детей до 8 лет, но не сопровождается преждевременным усилением секреции гонадолиберина. И наоборот — у детей с первичной надпочечниковой недостаточностью адренархе не наступает, но секреция гонадолиберина усиливается в положенный срок.
Повышение секреции гонадолиберина, ЛГ и ФСГ регулируется множеством факторов, но пусковым механизмом, как полагают, служит ослабление чувствительности гипоталамо-гипофизарной системы к циркулирующим в крови стероидным гормонам. Запускать половое развитие могут также стимулирующее действие или прекращение ингибирующего действия медиаторов. Один из первых признаков начала пубертатного периода — это усиление импульсной секреции ЛГ во время сна. Усиленная импульсная секреция Л Г во сне наблюдается также у детей с идиопатическим преждевременным половым развитием, у детей с агенезией гонад, когда после 11 лет вновь повышается уровень гонадотропных гормонов, и у женщин с нервной анорексией, которые начали набирать вес.
Повышение уровней эстрогенов в пубертатном периоде способствует ускорению роста. Яичниковые (и в меньшей степени надпочечниковые) андрогены регулируют подмышечное и лобковое оволосение. Время наступления и скорость полового созревания различны у разных групп населения. У большинства девочек в 10—11 лет увеличиваются молочные железы. Затем появляется подмышечное и лобковое оволосение, ускоряется рост, причем пик ускорения роста более чем у половины девочек приходится на возраст 11,4 года. В регуляции пубертатного ускорения роста участвуют СТГ, ИФР-1 и эстрогены. СТГ стимулирует выработку ИФР-1, особенно в печени. На протяжении пубертатного периода уровень ИФР-1 неуклонно растет. Этот рост обусловлен стимулирующим влиянием эстрогенов на секрецию СТГ. Если же уровень ИФР-1 не повышается, то ускорения роста не происходит (именно этим объясняется низкий рост африканских пигмеев).
Кульминацией полового развития становится начало регулярных, периодичных, спонтанных и предсказуемых овуляторных менструаций. Возраст менархе различен и зависит от социально-экономических и генетических факторов, общего состояния здоровья, питания. В США за последние 100 лет возраст менархе каждые 10 лет уменьшался на 3—4 мес, а в настоящее время он составляет в среднем 12,7 года. Полагали, что снижение возраста менархе было обусловлено в основном улучшением питания, хотя в целом процессы ускорения полового развития трудно объяснить физическими и социальными факторами, так как возникают и прекращаются они довольно независимо от экономического статуса того или иного региона. Frisch et al. исследовали 169 девочек и показали, что для наступления менархе необходимо, чтобы вес девочки достиг в среднем 48 кг. Однако и Frisch, и другие исследователи предполагали, что возраст менархе и становление овуляторного менструального цикла зависят также от других факторов, в том числе от содержания жировой ткани и воды в организме, безжировой массы тела и ее соотношения с массой жировой клетчатки, а также от типа телосложения. У девочек с весом, превышающим идеальный на 20—30%, менархе наступало раньше, чем у девочек с нормальным весом. И напротив, у худых девочек (например, у тех, которые плохо питаются, страдают тяжелыми хроническими заболеваниями) менархе наступает позже. Теория «критического» веса остается умозрительной и неоднозначной, а согласно еще одной теории, на созревание и активацию механизма импульсной секреции гонадолиберина влияют «метаболические сигналы», связанные с телосложением. Одним из таких сигналов может быть лептин, вырабатываемый жировой тканью.
Яичники взрослой женщины
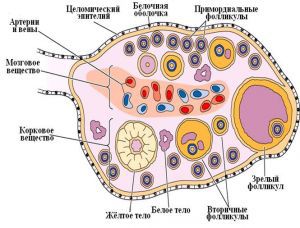
Яичники взрослой женщины имеют овальную форму, длину от 2 до 5 см, ширину 1,5—3 см и толщину 0,5—1,5 см. Вес яичника в детородном периоде составляет от 5 до 10 г (в среднем 7 г). Яичники прилежат к задней и боковой стенкам таза, каждый из них соединен с задней поверхностью широкой связки матки складкой брюшины — брыжейкой яичника. В яичнике выделяют корковое вещество, мозговое вещество и ворота. Корковое вещество содержит фолликулы, мозговое — состоит из соединительной ткани и сосудов и расположено в области ворот яичника.
Фолликулы
Фолликулы располагаются в корковом веществе яичника; они окружены соединительной тканью. Большинство фолликулов остаются неактивными в течение всего детородного периода. Они называются примордиальными. Каждый менструальный цикл несколько примордиальных фолликулов начинают интенсивно расти, претерпевая существенные изменения в размере, строении и функции. Растущий фолликул проходит следующие стадии: первичный фолликул, вторичный фолликул, третичный фолликул и атретическое тело. Первые две стадии проходят без воздействия гонадотропных гормонов и, по-видимому, регулируются гормонами самих яичников. Однако для окончательного созревания фолликула гонадотропные гормоны необходимы.
Каждый менструальный цикл происходит отбор нескольких примордиальных фолликулов, один из которых в дальнейшем дает начало яйцеклетке. Примордиальный фолликул состоит из одного слоя гранулезных клеток и ооцита I порядка, остановившегося в диплотене первого мейотического деления. От окружающей стромы яичника примордиальные фолликулы отделены тонкой базальной мембраной. Оболочка ооцита состоит из веретенообразных гранулезных клеток. Отростки гранулезных клеток проникают в базальную мембрану и обеспечивают поступление питательных веществ к ооциту.
В растущем примордиальном фолликуле происходят определенные изменения. Веретенообразные гранулезные клетки приобретают кубическую форму. Ооцит увеличивается в размере и секретирует слизистое вещество, содержащее гликопротеиды и отделяющее ооцит от гранулезных клеток. Это вещество называется прозрачной оболочкой. Эти изменения определяют превращение примордиального фолликула в первичный.
На стадии вторичного фолликула продолжается пролиферация гранулезных клеток, формируется оболочка фолликула, завершается рост ооцита. По мере роста фолликула вокруг него организуется строма яичника. Ее клетки располагаются концентрическими слоями вокруг фолликула и образуют его оболочку. Вскоре оболочка дифференцируется на два слоя: внешний и внутренний. Клетки внутренней оболочки прилежат к базальной мембране фолликула, а клетки наружной оболочки сливаются с окружающей фолликул соединительной тканью. На этой же стадии фолликул приобретает собственное кровоснабжение. К базальной мембране подходят артериолы, распадающиеся затем на капилляры. Но к ооциту и гранулезным клеткам кровь не поступает, так как базальная мембрана непроницаема для нее. В гранулярном слое вторичного фолликула встречаются тельца Калла—Экснера. Механизм их образования и физиологическая роль не известны.
Стадия третичного фолликула характеризуется дальнейшим утолщением теки и появлением между гранулезными клетками полости, заполненной жидкостью. Жидкость состоит из белков плазмы и секрета гранулезных клеток. Щелевые контакты между гранулезными клетками пропускают мелкие молекулы, обеспечивая клеточные взаимодействия и синхронизацию функций яичника.
Под действием ФСГ третичный фолликул быстро увеличивается в размерах и окончательно созревает. Ооцит и гранулезные клетки по-прежнему окружены базальной мембраной и лишены непосредственного кровоснабжения. Объем жидкости внутри фолликула увеличивается, и ооцит, окруженный гранулезными клетками, смещается к одному из полюсов фолликула, образуя яйценосный бугорок. На этой стадии зрелый фолликул готов к овуляции.
В процессе атрезии ооцит и гранулезные клетки внутри базальной мембраны замещаются соединительной тканью. В отличие от них клетки внутренней и наружной оболочки не погибают, а вновь превращаются в строму яичника. Полагают, что атрезия наступает при нехватке определенных гормонов или факторов роста, вырабатываемых зрелым фолликулом. Атрезия фолликулов обеспечивается запрограммированной гибелью клеток — апоптозом.
Яйцеклетка
В зрелом фолликуле в ооците возобновляется мейоз. Кроме того, происходит накопление питательных веществ и генетического материала, которые потребуются для развития зиготы после оплодотворения. До стадии третичного фолликула ооцит продолжает увеличиваться в размере, затем его рост прекращается.
Гранулезные клетки играют важную роль в развитии ооцита. Группа гранулезных клеток вокруг ооцита называется лучистым венцом. Клетки лучистого венца взаимодействуют с ооцитом посредством щелевых контактов. Прозрачная оболочка (состоящая из трех разных гликопротеидов) образуется между лучистым венцом и ооцитом еще в стадии первичного фолликула и выполняет целый ряд функций, в частности связывается со сперматозоидом, препятствует оплодотворению яйцеклетки несколькими сперматозоидами, а также облегчает продвижение эмбриона по маточной трубе в матку.
Сигналом к возобновлению мейоза служит преовуляторный выброс ЛГ. Высказывалось предположение, что существуют некие вещества, подавляющие мейоз in vivo до наступления овуляции; в пользу этого предположения говорит то, что ооциты из третичных фолликулов in vitro проходят мейоз полностью. При возобновлении мейоза растворяется ядерная оболочка, происходит конденсация хроматина, гомологичные хромосомы расходятся, а затем процесс вновь останавливается — в метафазе второго деления. Завершается мейоз образованием второго полярного тельца во время оплодотворения. Для нормального хода мейоза необходимы высокие уровни эстрадиола в фолликулярной жидкости.
Строма яичника
Строма яичника состоит из большого количества веретенообразных клеток, напоминающих фибробласты, интерстициальных клеток и межклеточного вещества. Интерстициальные клетки секретируют половые гормоны (в основном андрогены) и подвергаются морфологическим изменениям под действием ЛГ и ХГ. Интерстициальные клетки имеют мезенхимальное происхождение. Их разделяют на первичные, вторичные, текоциты и гилусные клетки.
Первичные интерстициальные клетки появляются в яичнике первыми, их можно обнаружить только между 12-й и 20-й неделями внутриутробного развития. Эти клетки напоминают клетки Лейдига в яичке плода и имеют ультраструктуру, характерную для клеток, секретирующих стероидные гормоны. Текоциты дифференцируются из мезенхимных клеток под влиянием гормонов, секретируемых вторичными фолликулами. В процессе дифференцировки мезенхимные клетки заметно увеличиваются в размере и приобретают ультраструктуру, характерную для клеток, секретирующих стероиды. Синтез стероидов в текоцитах, по-видимому, регулируется гонадотропными гормонами. При атрезии фолликула текоциты гипертрофируются и превращаются во вторичные интерстициальные клетки. Это крупные эпителиальные клетки, сохраняющие способность своих предшественников синтезировать стероидные гормоны и реагировать на воздействие ЛГ. Но в отличие от текоцитов, вторичные интерстициальные клетки имеют иннервацию и отвечают на действие катехоламинов структурными изменениями, усилением или ослаблением секреции стероидов.
В области ворот яичника находится особый вид интерстициальных клеток — так называемые гилусные клетки. Морфологически они почти неотличимы от клеток Лейдига яичка и так же, как и они, содержат кристаллы Рейнке. В этих клетках синтезируется тестостерон под действием ЛГ. При гиперплазии гилусных клеток или опухоли из них (подобно опухоли яичка, называемой лейдигомой) секреция тестостерона может усилиться, и развивается вирилизация. Роль гилусных клеток не ясна, однако их богатые кровоснабжение и иннервация заставляют предположить, что эти клетки регулируют функции яичника.
Желтое тело
Желтое тело образуется на месте зрелого фолликула после овуляции. Назальная мембрана, отделяющая гранулезные клетки от оболочки фолликула, после овуляции разрушается. Вслед за этим возникает желтое тело. В течение суток после овуляции происходит пролиферация гранулезных клеток. На 2-е сутки после Овуляции в них начинают прорастать капилляры, и к 4-м суткам они достигают полости фолликула. Кровоизлияние в полость фолликула может произойти в любой момент после овуляции, и к 5-м суткам в полости появляются фибробласты. Полость зрелого желтого тела выполнена кровяным сгустком. Максимальное кровоснабжение желтого тела отмечается на 7—8-е сутки после овуляции, что соответствует пику секреции прогестерона. Гранулезные клетки фолликула увеличиваются в размерах и становятся гранулезными лютеоцитами, а из текоцитов образуются текалютеоциты. Кроме того, в толще желтого тела разбросаны так называемые К-клетки — предположительно они представляют собой макрофаги.
Если беременности нет, то желтое тело подвергается обратному развитию, или инволюции. Первые признаки этого процесса становятся видны на 8-е сутки после овуляции. Гранулезные лютеоциты уменьшаются в размерах, и текалютеоциты становятся более заметны. В дальнейшем и те, и другие клетки погибают, по-видимому, путем апоптоза. Остатки желтого тела, называют белым телом.
Физиология яичников
Гипоталамо-гипофизарно-яичниковая система
Гипоталамусу принадлежит важнейшая роль в регуляции сложных взаимодействий, обеспечивающих работу женской репродуктивной системы. Гипоталамус связан с гипофизом воротной системой. Кровоток по ней направлен от гипоталамуса к гипофизу, и с током крови в гипофиз поступают гипота-ламические либерины и статины. Нарушение функции гипоталамо-гипофизар-ной системы приводит к дефициту гона-дотропных гормонов, снижению стерои-догенеза в яичниках и в итоге — к их атрофии.
Ранее считалось, что на выработку ЛГ и ФСГ влияют разные либерины и статины, однако дальнейшие исследования показали, что секреция обоих гормонов регулируется одним гонадолиберином. Более того, аналоги гонадолиберина также оказывают действие на секрецию обоих гормонов сразу. Воздействие гонадолиберина на ЛГ и ФСГ, как полагают, регулируется гормонами яичников по механизму обратной связи. На секрецию гонадолиберина влияют импульсы нервных волокон, идущих от других отделов головного мозга и оканчивающихся в ядре воронки. Секреция гонадолиберина усиливается под действием адреналина и норадреналина и снижается под действием дофамина, серотонина и эндогенных опиоидов.
Гонадолиберин стимулирует секрецию ЛГ и ФСГ, связываясь с высокоаффинными рецепторами на гонадотропных клетках гипофиза. Его действие не опосредуется цАМФ: стимуляция рецептора гонадолиберина приводит к активации фосфолипазы С и протеинкиназы С и выходу кальция из внутриклеточных депо. Гонадолиберин регулирует 1) синтез и запасание гонадотропных гормонов; 2) активацию гонадотропных гормонов и подготовку к секреции; 3) быстрое высвобождение гонадотропных гормонов. ЛГ, ФСГ, ТТГ и ХГ представляют собой гликопротеиды, состоящие из двух субъединиц, α и β. Альфа-субъединица состоит из 92 аминокислотных остатков, по-видимому, кодируется одним и тем же геном, поскольку одинакова для всех перечисленных гормонов. Бета-субъединица у каждого гормона своя; именно она отвечает за их биологическую активность. Для того чтобы гормон начал действовать, необходимо соединение α- и β-субъединиц.
Рост фолликулов, овуляция и функция желтого тела регулируются координированной секрецией ЛГ и ФСГ, а та, в свою очередь, — импульсной секрецией гонадолиберина гипоталамусом, как мы уже обсудили выше. Кроме того, на секрецию ЛГ и ФСГ влияют эстрогены и прогестерон, а также еще по крайней мере два пептидных гормона яичников. Эффект эстрогенов и прогестерона зависит от их концентрации и длительности воздействия.
Стероидные гормоны яичников
Прогестагены
Прегненолон почти не обладает гормональной активностью, но служит предшественником всех стероидных гормонов. Прогестерон — основной стероидный гормон желтого тела, он стимулирует секреторную активность и децидуальную реакцию эндометрия, разросшегося под действием эстрогенов. Кроме того, прогестерон уменьшает сократительную активность матки и повышает базальную температуру. Кроме него желтое тело секретирует 17-гидроксипрегненолон, но гормональная активность его незначительна.
Эстрогены
Эстрогены относятся к С18-стероидам и содержат бензольное кольцо А с гидроксильной (эстрадиол) или кетогруппой (эстрон) в положении С-3. Эстрадиол — основной и наиболее активный из эстрогенов, секретируемых яичниками. Эстрон также вырабатывается яичниками, но большая часть его образуется из андростендиона в периферических тканях. Эстриол (16-гидроксиэстрадиол) — основной эстроген, экскретируемый с мочой, — образуется в печени при метаболизме эстрона и эстрадиола. При ожирении и гипотиреозе продукция эстриола увеличивается. При гидроксилировании эстрогенов в положениях С-2 и С-4 образуются катехолэстрогены. Их физиологическая роль не совсем ясна, но известно, что при низком весе и гипотиреозе их концентрация возрастает.
Андрогены
В яичниках образуется ряд С19-стероидов. Основной С19-стероид, секретируемый клетками теки, — андростендион. Часть андростендиона поступает в кровь, а часть превращается в эстрон в гранулезных клетках. Андростендион сам по себе не обладает андрогенным действием, на ткани-мишени воздействуют только образующиеся из него тестостерон и дигидротестостерон — истинные андрогены, обладающие высоким сродством к рецепторам. При избыточной продукции С19-стероидов у новорожденных могут наблюдаться половые органы промежуточного типа, а у женщин — гирсутизм и вирилизация.
Стероидогенез
Стероидные гормоны, в том числе яичниковые, синтезируются из холестерина. Холестерин может восстанавливаться из эфиров холестерина, содержащихся в жировых включениях клеток, или синтезироваться в самих яичниках de novo, однако, по данным многих исследований, основной источник холестерина в яичниках — липопротеиды плазмы, прежде всего ЛПНП. Под действием ЛГ происходит активация аденилатциклазы и усиливается синтез цАМФ — внутриклеточного посредника, способствующего синтезу мРНК рецептора ЛПНП, а также захвату и связыванию холестерина ЛПНП и образованию эфиров холестерина. Кроме того, цАМФ активирует белок острой регуляции стероидогенеза (StAR), который переносит холестерин на внутреннюю мембрану митохондрий. Здесь происходит отщепление боковой цепи холестерина и его превращение в прегненолон — лимитирующая реакция стероидогенеза в яичниках. Катализирует ее ферментный комплекс, состоящий из 20,22-десмолазы, адренодоксина и флавопротеида.
Ген CYP19, кодирующий ароматазу, экспрессируется только в гранулезных клетках зрелого фолликула, что соответствует резкому увеличению синтеза эстрогенов перед овуляцией. Матричная РНК ароматазы в больших количествах присутствует в гранулезных лютеоцитах. В гранулезных клетках обнаруживается еще один фермент — 17р-гид-роксистероиддегидрогеназа типа 1, отвечающая за превращение эстрона в эстрадиол. Результаты исследования мРНК различных ферментов стероидогенеза соответствуют полученным ранее данным об активности ферментов в яичниках. Активность ароматазы и количество ее мРНК в гранулезных клетках увеличиваются под действием ФСГ.
Эти наблюдения позволяют понять, почему гранулезные клетки фолликула секретируют преимущественно эстрогены, текоциты — андрогены, а оба типа клеток желтого тела — прогестерон. Изучение особенностей стероидогенеза в изолированных гранулезных клетках и текоцитах позволило сформулировать двуклеточную теорию синтеза половых гормонов, согласно которой под действием ЛГ в текоцитах образуются С,9-стероиды (в основном андростендион), а затем под действием ФСГ в гранулезных клетках происходит ароматизация андростендиона и образуется эстрон. На завершающем этапе стероидогенеза из эстрона под действием 17р-гидрокси-стероиддегидрогеназы типа 1 образуется эстрадиол.
Количество стероидов, синтезируемых в яичниках, зависит также от поступления в них ЛПНП, служащих источником холестерина. Как отмечалось выше, гранулезные клетки лишены кровоснабжения, поэтому ЛПНП плазмы, молекулярная масса которых велика, обнаруживаются в фолликулярной жидкости лишь в небольших количествах. Таким образом, способность гранулезных клеток к синтезу прогестерона значительно меньше, чем клеток желтого тела. После овуляции, когда в фолликул прорастают капилляры и формируется желтое тело, холестерин начинает поступать в гранулезные клетки в большем количестве. Поэтому в лютеиновую фазу менструального цикла продукция прогестерона возрастает. Обработка желтого тела ХГ способствует усилению синтеза прогестерона и увеличению количества рецепторов ЛПНП in vitro.
Регуляция стероидогенеза в яичниках гонадотропными гормонами ФСГ и ЛГ необходимы для синтеза эстрогенов, а их соотношение регулирует количество эстрогенов, секретируемых яичниками. Рецепторы ФСГ есть только в гранулезных клетках. ФСГ усиливает активность ароматазы и синтез мРНК этого фермента в гранулезных клетках. (Напомним, что ароматаза отвечает за превращение андрогенов, синтезируемых текоцитами, в эстрогены). Усиленная секреция эстрадиола способствует увеличению числа рецепторов эстрадиола. В гранулезных клетках зрелого фолликула под действием ФСГ и эстрадиола увеличивается количество рецепторов ЛГ. Последний усиливает секрецию прогестерона гранулезными клетками, что способствует выбросу ФСГ в середине менструального цикла. Связывание гонадотропных гормонов с соответствующими мембранными рецепторами приводит к активации аденилатциклазы. После овуляции количество рецепторов ЛГ в клетках желтого тела увеличивается, а рецепторов ФСГ — уменьшается. Все эти наблюдения подчеркивают важную роль аутокринного и паракринного механизмов регуляции стероидогенеза и подтверждают двуклеточную теорию синтеза половых гормонов.
Стероидогенез в периферических тканях
Метод изотопного разведения пролил свет на сложные процессы, определяющие скорость продукции, скорость секреции и суммарный клиренс стероидных гормонов. Концепция экстрагонадного стероидогенеза позволила понять, каким образом регулируются уровни стероидных гормонов, особенно эстрогенов, в плазме. Скорость секреции стероидных гормонов — это их количество, выделяемое половыми железами в кровь в единицу времени. Стероидные гормоны могут также образовываться в периферических тканях из предшественников, секретируемых половыми или иными железами внутренней секреции. Скорость продукции стероидных гормонов — это скорость их поступления в кровоток, которая определяется суммой скорости секреции гормонов половыми железами и скорости их образования в периферических тканях. Если гормон образуется только в половых железах, то скорость секреции и скорость продукции равны. Если же гормон образуется не только в половых железах, но и в периферических тканях, то скорость продукции будет выше скорости секреции. Суммарный клиренс — это объем крови, полностью очищенный от гормона в единицу времени. Умножив его на концентрацию гормона в крови, можно рассчитать скорость продукции гормона.
Существует множество методов, позволяющих определить скорости секреции и продукции гормонов. Чаще всего используется метод изотопного разведения. При этом в/в вводят меченый гормон, пока его уровень в крови не станет постоянным, а затем определяют удельную радиоактивность плазмы, по которой вычисляют скорость продукции гормона. Если гормон образуется из нескольких предшественников, то в/в введение всех предшественников, меченных радиоактивными изотопами, позволяет определить их относительный вклад в скорость продукции гормона.
Описанные методы позволили установить, каковы источники эстрогенов плазмы. У здоровых женщин детородного возраста эстрадиол поступает в кровь в основном из яичников. Очень небольшое количество эстрадиола может образовываться в периферических тканях из тестостерона. Эстрон же, напротив, по большей части образуется в периферических тканях из андростендиона и — в меньшей степени — из эстрадиола, и лишь небольшое его количество секретируется яичниками. Ароматизация андростендиона в эстрон происходит главным образом в жировой ткани. На ее скорость влияет возраст, а также функция печени и щитовидной железы.
Синтез эстрогенов вне половых желез имеет важное клиническое значение. Их количество, образующееся в периферических тканях, может быть столь велико, что нарушает механизмы обратной связи и нормальный ход менструального цикла. Синтез эстрогенов в плаценте полностью зависит от продукции С19-стероидов надпочечниками плода и — в меньшей степени — надпочечниками матери. У небеременных женщин детородного возраста эстрон образуется из андростендиона, вырабатываемого яичниками и надпочечниками. В постменопаузе выработка андростендиона яичниками минимальна, однако концентрация эстрона в крови не снижается благодаря продукции андростендиона надпочечниками. Синтез эстрогенов усиливается с возрастом и при ожирении, что может привести к гиперплазии эндометрия и маточным кровотечениям. Гиперплазия эндометрия может возникать и у женщин детородного возраста с синдромом поликистозных яичников или опухолями яичников, секретирующими андростендион.
Транспорт стероидных гормонов яичников
Более 97—98% стероидных гормонов, образующихся в яичниках и периферических тканях, связаны с белками плазмы (альбумином или специфическими глобулинами). Так, тестостерон в основном связывается с ГСПГ, и лишь небольшая часть этого гормона связана с альбумином. Эстрадиол проявляет меньшее сродство к ГСПГ, чем тестостерон. Ранее считалось, что лишь свободные гормоны способны проникать в клетки-мишени и оказывать биологическое действие, однако недавние исследования позволили предположить, что транспорт стероидных гормонов более сложен.
ГСПГ (β-глобулин) образуется в печени, его молекулярная масса составляет 95 000. Он обладает высоким сродством к переносимым молекулам (10~9 моль/л), но низкой связывающей способностью (один связывающий центр на молекулу). Наибольшим после дигидроте-стостерона сродством к этому белку обладает тестостерон. Сродство эстрадиола к этому белку втрое ниже, чем у дигидротестостерона. Дегидроэпиандростерон и прогестерон имеют минимальное сродство к ГСПГ. Суммарный клиренс половых гормонов обратно пропорционален их сродству к этому белку, поэтому изменение его концентрации влияет на их метаболизм и действие на ткани-мишени. Уровни ГСПГ и, следовательно, уровни свободных гормонов могут изменяться при различных состояниях. Уровень ГСПГ повышается при гиперэстрогении (беременность, прием ОК.) и тиреотоксикозе и снижается при гиперандрогении, гипотиреозе и ожирении. У женщин уровень этого белка вдвое выше, чем у мужчин, что объясняется более высоким уровнем эстрогенов.
Механизм действия стероидных гормонов
Действие стероидных гормонов на клетки-мишени опосредуется специфическими рецепторами. Стероидные гормоны гидрофобны, имеют небольшую молекулярную массу и проникают в клетки путем диффузии, однако возможен их перенос через мембрану белками-переносчиками. Количество и специфичность рецепторов, а также их высокое сродство к гормонам, позволяют последним оказывать действие даже в небольших концентрациях. Эстрогены могут проникать в любые клетки, однако действие их проявляется лишь в тех органах, где имеются их рецепторы в клетках-мишенях (например, в матке).
Рецепторы стероидов находятся в ядрах клеток-мишеней. Ядерный рецептор стероидов состоит из нескольких доменов: гормонсвязывающего (С-конец), ДНК-связывающего, шарнирной области и домена трансактивации (N-конец). После связывания с гормоном в рецепторе начинаются конформационные изменения и активация гормон-рецепторного комплекса. Этот комплекс затем взаимодействует со специфическими последовательностями ДНК — гормон-чувствительными регуляторными элементами. В результате взаимодействия начинается синтез мРНК и затем, уже в цитоплазме, белков, которые и обеспечивают специфический клеточный ответ на действие гормонов.
Существует 2 типа эстрогеновых рецепторов — α-рецепторы и β-рецепторы. Альфа-рецепторы локализуются в клетках влагалища, матки и молочных желез, а β-рецепторы — в молочных железах и гранулезных клетках. Рецепторов прогестерона также 2 типа — А и В. Рецепторы типа В широко распространены в большинстве тканей. Функция рецепторов типа А менее изучена; они могут подавлять активность рецепторов типа В. Соотношение рецепторов типов А и В изменяется в процессе развития репродуктивной системы и имеет важное значение для ее нормального функционирования.
Менопауза и яичники
С возрастом запас фолликулов в яичниках истощается и наступает менопауза. Предшествующий менопаузе период постепенного угасания функции яичников называется менопаузальным переходом. Он характеризуется различными эндокринными, соматическими и психологическими изменениями.
Средний возраст менопаузы остается неизменным, что указывает на его независимость от возраста менархе, социально-экономического уровня, расы, количества родов в анамнезе, роста и веса.
Прогрессирующее уменьшение числа фолликулов приводит к снижению секреции эстрогенов. В постменопаузе яичники уменьшаются в размере, вес их составляет менее 2,5 г, поверхность становится морщинистой. Дальнейшее уменьшение количества фолликулов ведет к истончению коркового слоя.
Способность яичников отвечать на действие гонадотропных гормонов снижается за несколько лет до последней менструации. Во время менопаузального перехода созревание фолликулов и овуляторные менструальные циклы еще продолжаются, однако уровни ФСГ и ЛГ становятся выше. После прекращения роста фолликулов снижаются уровни эстрадиола и ингибина — факторов, оказывающих угнетающее действие на гипоталамо-гипофизарную систему.
Различию уровней гонадотропных гормонов существует два возможных объяснения:
- более высокий уровень ФСГ обусловлен снижением уровня ингибина;
- большее содержание сиаловой кислоты в ФСГ может снижать его клиренс.
В/в введение гонадолиберина во время постменопаузы дает повышение уровней как ФСГ, так и ЛГ — реакция, аналогичная наблюдаемой у женщин с другими формами яичниковой недостаточности.
В отличие от уровней гонадотропных гормонов, уровни половых стероидов в пре- и постменопаузе постепенно снижаются. Если в детородном периоде источниками андростендиона плазмы служат надпочечники и яичники, то после менопаузы яичники почти перестают синтезировать этот гормон и уровень андростендиона в плазме уменьшается вдвое. Как уже упоминалось, в детородном возрасте эстрогены поступают в плазму из двух источников. Более 60% эстрогенов плазмы составляет секретируемый яичниками эстрадиол, а остальные 40% приходятся на эстрон, образующийся в периферических тканях из андростендиона. После менопаузы продукция эстрадиола и андростендиона яичниками снижается, и основным источником эстрогенов становится образование эстрона из андростендиона, синтезируемого надпочечниками. Как и следовало ожидать, удаление яичников после менопаузы не вызывает заметного снижения уровней эстрогенов и андростендиона. Поскольку жировая ткань служит важным источником эстрогенов, у женщин с ожирением уровни эстрогенов в постменопаузе могут оставаться такими же, как у женщин детородного возраста, или да же превышать их. Итак, преобладающий вид эстрогенов в постменопаузе - эстрон.
Приливы проявляются ощущением жара и последующим обильным потоотделением. Частота, длительность и интенсивность приливов различны, но у большинства женщин их выраженность снижаете; через 2—5 лет после наступления менопаузы.
Отмечена четкая временная зависимость между прекращением секреции эстрогенов и развитием остеопороза. Потеря компактного и губчатого веществ при остеопорозе повышает хрупкость кости, увеличивая риск переломов. Потери костной ткани в постменопаузе составляют 1—2% в год. К 80 годам женщины теряют половину массы костной ткани. По оценкам, переломы позвонков или шейки бедренной кости возникают у 25% женщин от 60 до 90 лет. Такие переломы сопряжены с высоким риском осложнений и смерти. На заболеваемость остеопорозом влияют питание, подвижность, курение, общее состояние здоровья и, главное, дефицит эстрогенов.
Основная причина смертности в постменопаузе — сердечно-сосудистые заболевания.
