Ренин ангиотензиновая система
Термин «ренин» впервые был предложен Тигер-штедтом (Tigerstedt) и Бергманом (Bergman) в 1898 г. для обозначения прессорного вещества, присутствующего в солевом экстракте почек кролика.
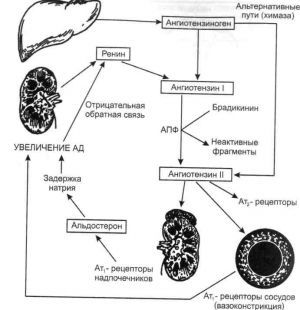
Пионерские исследования Пейджа (Page), Хелмера (Helmer) и Браун-Менендеса (Braun-Menendez) в 1930-х годах показали, что ренин представляет собой фермент, расщепляющий α2-глобулин (ангиотензиноген) с образованием декапептида (ангиотензина I). Последний затем расщепляется ангиотензинпревращающим ферментом (АПФ) с образованием октапептида (ангиотензина II), который обладает мощной сосудосуживающей активностью. В те же годы Гольдблатт (Goldblatt) установил, что снижение кровотока в почках экспериментальных животных приводит к повышению артериального давления. В дальнейшем эти два факта удалось связать между собой: снижение кровотока в почках стимулирует ренин-ангиотензиновую систему, что и приводит к повышению артериального давления. Данная схема формирует фундамент современных представлений о регуляции артериального давления.
Ренин
Гладкомышечные клетки в месте вхождения приносящей артериолы в почечный клубочек («юкстагломерулярные») обладают секреторной функцией; они вырабатывают и секретируют ренин — протеолитический фермент с молекулярной массой около 40000. К юкстагломерулярным примыкают специализированные клетки толстого восходящего колена петли Генле, расположенного в корковом веществе почек. Эта область нефрона носит название плотного пятна. Юкстагломерулярные клетки и плотное пятно вместе образуют юкстагломерулярный аппарат, и их взаимодействие играет важнейшую роль в регуляции секреции ренина.
Синтез ренина включает ряд этапов, начинающихся с трансляции рениновой мРНК в препроренин. N-концевая последовательность препроренина (из 23 аминокислотных остатков) направляет белок в эндоплазматический ретикулум, где отщепляется с образованием проренина. Проренин гликозилируется в аппарате Гольджи и либо прямо секретируется в кровь нерегулируемым образом, либо упаковывается в секреторные гранулы, где превращается в активный ренин. Хотя на долю проренина приходится целых 50-90% общего ренина крови, его физиологическая роль остается неясной. Вне почек он практически не превращается в ренин. При микроангиопатических осложнениях сахарного диабета 1-го типа уровень проренина в плазме несколько повышается.
Выделение ренина из секреторных гранул в кровь контролируется тремя основными механизмами:
- барорецепторами стенок приносящих артериол, которые стимулируются при снижении перфузионного давления; этот эффект опосредован, вероятно, местной продукцией простагландинов;
- рецепторами сердца и крупных артерий, которые активируют симпатическую нервную систему, приводя к повышению уровня катехоламинов в крови и прямой нервной стимуляции юкстагломерулярных клеток (через β1-адренорецепторы);
- клетками плотного пятна, которые стимулируются при снижении концентрации ионов Na+ и СГ в канальцевой жидкости, поступающей в этот сегмент нефрона. Главным посредником этого эффекта являются, по-видимому, ионы СГ.
Попав в кровь, ренин выщепляет декапептид ангиотензин I из N-концевой последовательности ангиотензиногена. Затем ангиотензин I под действием АПФ превращается в октапептид ангиотензин II. Концентрация АПФ наиболее высока в легких. Он присутствует также на люминальной мембране эндотелиальных клеток сосудов, в почечных клубочках, головном мозге и других органах. Различные ангиотензиназы, локализованные в большинстве тканей, быстро разрушают ангиотензин II, и его период полужизни в плазме составляет менее 1 минуты.
Ангиотензиноген
Ангиотензиноген (субстрат ренина) представляет собой α2-глобулин, секретируемый печенью. Концентрация этого белка (молекулярная масса около 60000) в плазме человека составляет 1 ммоль/л. В норме концентрация ангиотензиногена ниже Vмакс реакции, катализируемой ренином. Поэтому при увеличении концентрации ангиотензиногена количество образующегося ангиотензина при том же уровне ренина в плазме должно возрастать. При гипертонической болезни содержание ангиотензиногена в плазме повышено, и эта болезнь, по-видимому, сцеплена с вариантом аллеля гена ангиотензиногена. Глюкокортикоиды и эстрогены стимулируют печеночную продукцию ангиотензиногена, что обусловливает повышение артериального давления при приеме пероральных контрацептивов, содержащих эстрогены.
При уменьшении содержания Na+ в организме, сопровождающемся повышением уровня ренина в плазме, скорость метаболизма ангиотензиногена резко возрастает. Поскольку концентрация продуктов его распада в таких условиях не меняется, это возрастание, по-видимому, компенсируется повышенной печеночной продукцией ангиотензиногена. Механизм такого повышения остается неясным, хотя известно, что ангиотензин II стимулирует продукцию ангиотензиногена.
Ангиотензинпревращающий фермент
АПФ (дипептидил-карбоксипептидаза) представляет собой гликопротеин с молекулярной массой 130000-160000, который выщепляет дипептиды из многих субстратов. Помимо ангиотензина I, к таким субстратам относятся брадикинин, энкефалины и вещество Р. Ингибиторы АПФ широко используются для предотвращения образования ангиотензина II в крови и, тем самым, блокады его эффектов. Поскольку АПФ действует на целый ряд субстратов, результаты ингибирования этого фермента не всегда сводятся к изменению активности ренин-ангиотензиновой системы. Действительно, в гипотензивном эффекте ингибиторов АПФ может играть роль повышение уровня кининов, которые способствуют высвобождению оксида азота из эндотелия сосудов. Антагонисты брадикинина ослабляют гипотензивный эффект ингибиторов АПФ. Повышение уровня кининов может опосредовать и другой эффект ингибиторов АПФ, а именно — увеличение чувствительности тканей к инсулину и снижение уровня глюкозы в крови у больных сахарным диабетом 2-го типа. Кроме того, накопление кининов может лежать в основе двух из наиболее важных побочных эффектов ингибиторов АПФ: кашля, отека Квинке и анафилаксии.
Превращать ангиотензин I в ангиотензин II, помимо АПФ, могут и сериновые протеазы, называемые химазами. Эти ферменты присутствуют в различных тканях; их активность особенно высока в желудочках сердца. Таким образом, существует и АПФ-независимый механизм образования ангиотензина II.
Ангиотензин II
Подобно другим пептидным гормонам, ангиотензин II связывается с рецепторами, локализованными на плазматической мембране клеток-мишеней. Описаны два класса рецепторов ангиотензина II — AT1 и АТ2; их мРНК выделены и клонированы. Практически все известные сердечно-сосудистые, почечные и надпочечниковые эффекты ангиотензина II реализуются через рецепторы AT1, тогда как рецепторы АТ2 могут опосредовать влияние этого пептида на дифференцировку и рост клеток. Рецепторы обоих классов содержат семь трансмембранных доменов. AT1 сопряжены с G-белком, который активирует фосфолипазу С, усиливая, тем самым, гидролиз фосфоинозитида с образованием инозитолтрифосфата и диацилглицерина. Эти «вторые мессенджеры» запускают каскад внутриклеточных реакций, включающих повышение концентрации кальция в клетках, активацию протеинкиназ и, вероятно, снижение внутриклеточной концентрации цАМФ. Механизм проведения сигнала от рецепторов АТ2 остается неизвестным.
Ангиотензин II является мощным прессорным фактором; сужая артериолы, он увеличивает общее периферическое сопротивление. Вазоконстрикция происходит во всех тканях, включая почки, и играет роль в механизме ауторегуляции почечного кровотока. Кроме того, ангиотензин II увеличивает частоту и силу сердечных сокращений.
Действуя непосредственно на кору надпочечников, ангиотензин II стимулирует секрецию альдостерона, и является наиболее важным регулятором секреции этого гормона. Он играет ключевую роль в регуляции баланса Na+. Например, уменьшение объема внеклеточной жидкости при недостаточном потреблении Na+ стимулирует ренин-ангиотензиновую систему. С одной стороны, вазоконстрикторное действие ангиотензина II способствует поддержанию артериального давления в условиях сниженного внеклеточного объема жидкости, а с другой — ангиотензин II стимулирует секрецию альдостерона, вызывая задержку натрия, что способствует сохранению объема плазмы.
При хроническом уменьшении внутрисосудистого объема, характерном для низкого потребления Na+, постоянно повышенный уровень ангиотензина II обусловливает снижение числа рецепторов AT1 в сосудах, и степень вазоконстдэикции оказывается меньше ожидаемой. В отличие от этого, число рецепторов AT1 в клубочковой зоне коры надпочечников при снижении внутрисосудистого объема увеличивается, и секреция альдостерона под действием ангиотензина II возрастает в большей степени. Предполагается, что противоположные влияния хронического снижения внутрисосудистого объема на чувствительность сосудов и надпочечников к ангиотензину II физиологически оправданы: в условиях низкого потребления Na+ резкое усиление секреции альдостерона увеличивает реабсорбцию этого иона в почках без значительного повышения артериального давления. В некоторых случаях гипертонической болезни такая «натриевая модуляция» чувствительности надпочечников и сосудов к ангиотензину II нарушается.
Ангиотензин II усиливает реакции периферических сосудов и сердца на симпатические влияния (за счет облегчения секреции норадреналина нервными окончаниями и повышения чувствительности гладкомышечной оболочки сосудов к этому трансмиттеру). Кроме того, под влиянием ангиотензина II возрастает секреция адреналина мозговым веществом надпочечников.
В клинике используют ряд антагонистов ангиотензина II, которые действуют только на AT1-рецепторы, не влияя на эффекты, опосредуемые АТ2-рецепторами. С другой стороны, ингибиторы АПФ снижают активность рецепторов обоих классов. Блокаторы ангиотензиновых рецепторов не влияют на уровень брадикинина. Поскольку ингибиторы АПФ снижают артериальное давление отчасти за счет повышения уровня брадикинина, а ангиотензин II образуется даже при блокаде АПФ, сочетание ингибиторов АПФ с блокаторами ATl может снижать артериальное давление в большей степени, чем каждый из этих препаратов в отдельности.
Блокада образования и периферических эффектов ангиотензина II используется в терапевтических целях. Например, повышение уровня ангиотензина II при застойной сердечной недостаточности с низким сердечным выбросом способствует задержке соли и воды и, вызывая вазоконстрикцию, увеличивает периферическое сосудистое сопротивление, а тем самым, и посленагрузку на сердце. Ингибиторы АПФ или блокаторы ангиотензиновых рецепторов расширяют периферические сосуды, улучшают перфузию тканей и производительность миокарда, а также способствуют выведению соли и воды через почки.
Влияние ангиотензина II на головной мозг
Ангиотензин II — полярный пептид, не проникающий через гематоэнцефалический барьер. Однако он может влиять на мозг, действуя через структуры, прилегающие к мозговым желудочкам и лежащие за пределами гематоэнцефалического барьера. Особое значение в действии ангиотензина II имеют субфорникальный орган, сосудистый орган терминальной пластинки и каудальная часть дна IV желудочка.
Ангиотензин II вызывает сильную жажду. Рецепторы, опосредующие этот эффект, расположены преимущественно в субфорникальном органе. Под влиянием ангиотензина II усиливается также секреция вазопрессина (в основном из-за повышения осмоляльности плазмы). Таким образом, ренин-ангиотензиновая система может играть важную роль в регуляции водного баланса, особенно в условиях гиповолемии.
Ряд моделей патогенеза артериальной гипертонии предполагает образование ангиотензина II непосредственно в мозге. Однако степень повышения артериального давления, обусловленная мозговыми эффектами ангиотензина II, значительно меньше той, которая связана с непосредственным влиянием этого пептида на сосуды. У большинства животных рецепторы, опосредующие мозговые гипертензивные эффекты ангиотензина II, расположены в area postrema. Другие центральные эффекты ангиотензина II включают стимуляцию секреции АКТГ, снижение АРП и усиление тяги к соли, особенно в связи с повышением уровня минералокортикоидов. Значение всех этих (и других) центральных эффектов ангиотензина еще предстоит выяснить.
Локальные ренин-ангиотензионовые системы
Все компоненты ренин-ангиотензиновой системы присутствуют не только в общем кровотоке, но и в различных тканях, и поэтому ангиотензин II может образовываться локально. К таким тканям относятся почки, головной мозг, сердце, яичники, надпочечники, яички и периферические сосуды. В почках ангиотензин II прямо стимулирует ре-абсорбцию Na+ в верхних сегментах проксимальных канальцев (отчасти за счет активации контртранспорта Na+/H+ на люминальной мембране). Ангиотензин II местного или системного происхождения играет также ключевую роль в поддержании СКФ при гиповолемии и снижении артериального кровотока. Под влиянием ангиотензина II выносящие артериолы сужаются в большей степени, чем приносящие, что приводит к повышению гидравлического давления в капиллярах почечных клубочков и препятствует снижению СКФ при уменьшении перфузии почек.
Ренин-ангиотензиновая система и артериальная гипертония
Гипертоническая болезнь
{module директ4}
Артериальное давление зависит как от минутного объема сердца, так и от периферического сопротивления сосудов. Гипертоническая болезнь обусловлена повышением именно периферического сосудистого сопротивления, которое, в свою очередь, определяется сложным взаимодействием множества системно и местно продуцируемых гормонов и факторов роста, а также нейрогенными влияниями. Однако конкретный фактор (или факторы), лежащий в основе патогенеза гипертонической болезни, до сих пор не установлен. Известные данные об увеличении артериального давления при нарушении перфузии почек и повышении секреции ренина позволяют усматривать роль ренин-ангиотензиновой системы в этиологии гипертонической болезни.
Еще в начале 1970-х годов Лара (Laragh) с сотр. предложили оценивать относительную роль вазоконстрикции и увеличения внутрисосудистого объема в патогенезе гипертонической болезни по АРП. При повышенной АРП ведущим механизмом развития этой болезни считалась вазоконстрикция, а при низкой АРП — увеличение внутрисосудистого объема. Хотя такое представление теоретически оправдано, оно не всегда подтверждается результатами исследования гемодинамики. Кроме того, средства, влияющие на ренин-ангиотензиновую систему (ингибиторы АПФ, блокаторы ангиотензиновых рецепторов), помогают даже при гипертонической болезни с низкой АРП.
Как отмечалось выше, диета с низким содержание Na+ увеличивает реакцию надпочечников на ангиотензин II, одновременно снижая чувствительность сосудов к этому пептиду. Нагрузка Na+ оказывает противоположное действие. У здорового человека, потребляющего большое количество Na+, изменение реактивности надпочечников и сосудов способствует повышению почечного кровотока и снижению реабсорбции Na+ в почках. И то, и другое облегчает выведение избыточного количества Na+ из организма. Почти в 50% случаев гипертонической болезни с нормальной или повышенной АРП находят нарушение способности выводить натриевую нагрузку. Предполагается, что основной дефект связан либо с локальной продукцией ангиотензина II, либо с нарушением его рецепторов, вследствие чего колебания в потреблении Na+ не меняют реактивности тканей-мишеней. Ингибиторы АПФ, снижая уровень ангиотензина И, восстанавливают реактивность надпочечников и сосудов в таких случаях.
Примерно у 25% больных АРП снижена. Артериальная гипертония с низкой АРП чаще обнаруживается у представителей черной расы и пожилых людей. Предполагается, что в этих случаях артериальное давление особенно чувствительно к соли, и его снижения легче всего добиться с помощью диуретиков и антагонистов кальция. Хотя раньше считали, что ингибиторы АПФ неэффективны при гипертонической болезни с низкой АРП, недавние исследования показывают, что величина АРП не может служить предиктором эффективности лекарственных средств этого класса. Не исключено, что эффективность ингибиторов АПФ в таких случаях связана с повышением уровня брадикинина или с торможением местной продукции ангиотензина II в почках, головном мозге и сосудах. Это подтверждается недавними исследованиями на трансгенных крысах (носителях мышиного гена ренина). У таких крыс наблюдалась тяжелая и часто летальная форма артериальной гипертонии, которую удавалось ослабить ингибиторами АПФ или блокаторами ангиотензиновых рецепторов. Хотя АРП, а также уровни ангиотензина II в плазме и ренина в крови почечной вены у этих животных были сниженными, содержание ренина в надпочечниках и уровень проренина в плазме оказались повышенными, причем адреналэктомия приводила к снижению артериального давления. Таким образом, АРП в системной крови не отражает состояния локальной ренин-ангиотензиновой системы и ее роли в патогенезе артериальной гипертонии.
Недавние молекулярные исследования также подтверждают участие ренин-ангиотензиновой системы в патогенезе гипертонической болезни. У сибсов обнаружено сцепление между аллелем гена ангиотензиногена и гипертонической болезнью. Выявлена корреляция между уровнем ангиотензиногена в плазме и артериальным давлением; при гипертонической болезни концентрация ангиотензиногена повышена. Больше того, если родители страдают гипертонической болезнью, то уровень ангиотензиногена повышен и у их детей с нормальным артериальным давлением.
Реноваскулярная гипертония
Реноваскулярная гипертония — наиболее распространенная причина ренинзависимого повышения артериального давления. По разным данным, она обнаруживается у 1-4% больных с артериальной гипертонией и является наиболее курабельной формой этого заболевания. Среди афроамериканцев патология почечной артерии и реноваскулярная гипертония встречаются реже, чем среди представителей белой расы. Атеросклероз или фиброзно-мышечная гиперплазия стенок почечных артерий приводят к снижению перфузии почек и усилению продукции ренина и ангиотензина II. Артериальное давление повышается, но высокий уровень ангиотензина II подавляет секрецию ренина контрлатеральной почкой. Поэтому общая АРП может оставаться нормальной или возрастать лишь в незначительной степени. Повышение артериального давления может быть связано и с другими анатомическими причинами: инфарктом почек, кистами, гидронефрозом и т. п.
Учитывая относительно невысокую частоту таких случаев, скрининг всех больных с повышенным артериальным давлением на реноваскулярную гипертонию нецелесообразен. Вначале следует убедиться в «неидиопатической» природе артериальной гипертонии у данного больного.
Реноваскулярную гипертонию следует подозревать в следующих случаях:
- при тяжелой гипертонии (диастолическое артериальное давление > 120 мм рт. ст.) с прогрессирующей почечной недостаточностью или рефрактерностью к агрессивной медикаментозной терапии;
- при быстром нарастании артериального давления или злокачественной гипертонии с ретинопатией III или IV стадии;
- при умеренной или тяжелой гипертонии у больных с диффузным атеросклерозом или случайно выявленной асимметрией размеров почек;
- при остром повышении уровня креатинина в плазме (вследствие неизвестных причин или на фоне лечения ингибиторами АПФ);
- при остром повышении ранее стабильного артериального давления;
- при прослушивании систоло-диастолического шума над брюшной аортой;
- при развитии гипертонии у людей моложе 20 лет или старше 50 лет;
- при умеренной или тяжелой гипертонии у людей с повторными эпизодами отека легких;
- при гипокалиемии на фоне нормальной или повышенной АРП в отсутствие диуретической терапии;
- при отсутствии артериальной гипертонии в семейном анамнезе.
Острое ухудшение функции почек на фоне лечения ингибиторами АПФ или блокаторами ангиотензиновых рецепторов указывает на двусторонний стеноз почечных артерий. В такой ситуации давление в клубочках обеих почек поддерживается ангиотензином II, сужающим выносящие артериолы, а устранение этого эффекта приводит к снижению внутриклубочкового давления и СКФ.
Стандартным методом диагностики поражения почечных сосудов является ангиография почек. Однако это исследование сопряжено с риском острого некроза канальцев, и поэтому применяют неинвазивные способы визуализации почечных сосудов и фармакологические пробы. К современным методам диагностики реноваскулярной патологии относятся: 1) стимуляционная проба с каптоприлом и определением АРП; 2) ренография с каптоприлом; 3) доплеровское исследование; 4) магнитно-резонансная ангиография (МРА); 5) спиральная КТ.
Само по себе повышение базального уровня ренина в плазме не доказывает наличия реноваскулярной гипертонии, так как он повышен лишь у 50-80% таких больных. В норме ингибитор АПФ каптоприл, блокируя действие ангиотензина II по механизму отрицательной обратной связи, вызывает реактивную гиперренинемию. У больных со стенозом почечной артерии эта реакция усилена, и уровень ренина, определяемый через 1 час после приема каптоприла, оказывается гораздо выше, чем при гипертонической болезни. Чувствительность и специфичность этой пробы составляют соответственно 93-100% и 80-95%. Она менее чувствительна у лиц черной расы, у молодых больных, у больных с почечной недостаточностью или получающих гипотензивную терапию.
Стеноз почечной артерии стимулирует ренин-ангиотензиновую систему ипсилатеральной почки, и ангиотензин II, сужая выносящие артериолы, способствует сохранению внутриклубочкового давления и СКФ. Ингибиторы АПФ (например, каптоприл) снижают продукцию ангиотензина II и, тем самым, понижают давление в клубочках и СКФ. Изотопное сканирование почек до и после приема каптоприла позволяет выявить одностороннюю ишемию почки. Если максимальное накопление изотопа в одной почке снижено или замедлено по сравнению с другой, то это указывает на поражение почечных сосудов. Чувствительность данной пробы у больных группы высокого риска по стенозу почечной артерии достигает 90%.
Недавно для диагностики стеноза почечных артерий начали использовать сочетание дуплексного УЗИ почек с измерением артериального почечного кровотока (доплеровским исследованием). Специфичность такого комплексного метода превышает 90%, но зависит от опыта исследователя. Скопление газов в кишечнике, ожирение, недавно перенесенные операции или присутствие добавочной почечной артерии затрудняют визуализацию стеноза. Данные о скорости кровотока, полученные при доплеровском исследовании, позволяют рассчитать сопротивление в почечной артерии и решить, кому из больных может помочь реваскуляризация.
В отличие от старых наблюдений, в которых чувствительность МРА оценивалась в 92-97%, современные исследования свидетельствуют лишь о 62% чувствительности и 84% специфичности этого метода. Чувствительность МРА особенно низка при стенозе почечной артерии, связанном с фиброзно-мышечной дисплазией. Самым чувствительным методом обнаружения стеноза почечной артерии является, по-видимому, спиральная КТ; чувствительность и специфичность этого метода в отдельных исследованиях достигала соответственно 98% и 94%.
В связи с отсутствием достаточно чувствительных неинвазивных методов, которые позволяли бы полностью исключить стеноз почечной артерии, клиницистам нередко приходится решать, когда и как исследовать состояние почечного кровотока у больных с артериальной гипертонией. Манн (Mann) и Пиккеринг (Pickering), исходя из индекса клинического подозрения, предложили практический алгоритм отбора больных для диагностики реноваскулярной гипертензии и ангиографии почек. У больных группы умеренного риска целесообразно начинать с доплеровского исследования с расчетом сопротивления почечных сосудов.
Больным с реноваскулярной гипертонией показана анатомическая коррекция почечных сосудов. Если при артериографии обнаруживается сужение одной или обеих почечных артерий больше чем на 75%, это указывает на возможность почечного генеза артериальной гипертонии. О гемодинамическом значении стеноза можно судить, определяя уровень ренина в крови почечной вены на стороне стеноза и сопоставляя его с уровнем ренина в крови, оттекающей от контрлатеральной почки. Значимым обычно считают отношение этих уровней больше 1,5, хотя и меньшее отношение не исключает диагноз. Прием ингибитора АПФ до катетеризации почечных вен может повысить чувствительность этой пробы. Хирургическое лечение нормализует артериальное давление более чем у 90% больных со стенозом почечной артерии и односторонним повышением секреции ренина. Однако ангиопластика или хирургическая операция эффективны и у многих больных с отношением уровней ренина в обеих почечных венах меньше 1,5. Поэтому определение такого отношения при значительном стенозе почечной артерии больше не считается необходимым. Этот показатель может быть полезным при двустороннем стенозе или стенозе сегментарных почечных артерий, так как позволяет установить, какая почка или ее сегмент является источником повышенной продукции ренина.
Предвидеть эффективность реваскуляризации почки помогает расчет индекса сопротивления почечной артерии [(1 — скорость кровотока в конце диастолы)/(максимальная скорость кровотока в систолу) х 100] по данным дуплексного доплеровского исследования. При индексе сопротивления больше 80 хирургическое вмешательство, как правило, оказывалось безуспешным. Примерно у 80% больных функция почки продолжала ухудшаться, а существенное снижение артериального давления наблюдалось только у одного больного. Напротив, при индексе сопротивления меньше 80 реваскуляризация почки приводила к снижению артериального давления больше чем у 90% больных. Высокий индекс сопротивления свидетельствует, вероятно, о поражении внутрипочечных сосудов и гломеру-лосклерозе. Поэтому восстановление проходимости главных почечных артерий в таких случаях не снижает артериального давления и не улучшает функции почек. Недавние исследования подтвердили отсутствие снижения артериального давления после реваскуляризации у больных с выраженным стенозом почечных артерий (> 70%) и сниженной функцией почек (СКФ < 50 мл/мин). Однако СКФ после реваскуляризации несколько увеличивалась.
Анатомическую коррекцию почечных артерий производят либо путем чрескожной ангиопластики (со стентированием или без него), либо прямым хирургическим вмешательством. Вопрос об оптимальном методе лечения остается открытым, так как рандомизированных исследований, в которых сравнивались бы результаты ангиопластики (со стентированием или без него), хирургической операции и медикаментозной терапии, не проводилось. При фиброзно-мышечной дисплазии методом выбора является все же ангиопластика, которая, по разным данным, излечивает 50-85% больных. В 30-35% случаев ангиопластика улучшает состояние больных, и только менее чем в 15% случаев оказывается неэффективной. При атеросклеротическом стенозе почечных артерий выбор метода лечения гораздо более труден. Успех вмешательства зависит от места сужения артерий. В целом при поражении главных почечных артерий лучшие результаты дает ангиопластика, а при сужении их устьев требуется стентирование. Одна только ангиопластика при атеросклерозе почечных артерий устраняет артериальную гипертонию у 8-20% больных, приводит к снижению давления в 50-60% случаев и оказывается неэффективной в 20-30% случаев. Кроме того, в течение 2 лет после такой процедуры у 8-30% больных наблюдается рестеноз почечной артерии. Еще менее успешна ангиопластика при двустороннем поражении почечных артерий или хронической артериальной гипертонии. Для повышения эффективности ангиопластики используют стенты. По данным ряда неконтролируемых исследований, снижение артериального давления в таких случаях наблюдается у 65-88% больных, а рестеноз развивается лишь у 11-14% из них. При проведении реваскуляризации почек необходимо учитывать риски атероэмболии (связанной с ангиографией), ухудшения почечной функции и нефротоксичности (вследствие применения йодированных рентгено-контрастных веществ).
Другая важная проблема заключается в оценке возможности улучшения функции почек после вмешательства, особенно при двустороннем стенозе почечных артерий со снижением почечного кровотока и СКФ, но обсуждение этой проблемы выходит за рамки задач данной главы. Лечение больных с атеросклеротическим стенозом почечной артерии требует принятия общих мер борьбы с атеросклерозом — отказа от курения, достижения целевых значений артериального давления и устранения нарушений липидного обмена. Недавно показано, что статины не только замедляют, но и способствуют регрессу атеросклеростических повреждений.
Хирургическая коррекция стеноза почечной артерии обычно производится путем эндартерэктомии или шунтирования. Эти методы, как правило, эффективнее ангиопластики, но операция может сопровождаться и большей смертностью, особенно у пожилых больных с сопутствующими сердечно-сосудистыми заболеваниями. В большинстве медицинских центров реваскуляризацию почек предпочитают производить методом чрескожной ангиопластики с установкой стентов, особенно при стенозах устьев почечных артерий. Хирургическую реваскуляризацию проводят лишь при неэффективности ангиопластики или при необходимости одновременной операции на аорте.
В случаях общего плохого состояния больного или сомнений в диагнозе используют медикаментозное лечение. Недавние рандомизированные контролируемые исследования показали, что рева-скуляризация почек у больных с подозрением на реноваскулярную гипертонию, получающих консервативное медикаментозное лечение, не всегда дает желаемые результаты. Особенно эффективными являются ингибиторы АПФ и селективные антагонисты AT1-рецепторов, хотя, как уже упоминалось, при двустороннем стенозе почечных артерий они могут снижать сопротивление выносящих клубоч-ковых артериол и, тем самым, ухудшать функцию почек. Применяют также β-адреноблокаторы и антагонисты кальция.
Ренинсекретирующие опухоли
Ренинсекретирующие опухоли встречаются крайне редко. Обычно они представляют собой гемангиоперицитомы, содержащие элементы юкстагломерулярных клеток. Эти опухоли выявляются при КТ и характеризуются повышенным уровнем ренина в венозной крови пораженной почки. Описаны и другие ренинсекретирующие новообразования (например, опухоль Вильмса, опухоли легких), сопровождающиеся вторичным альдостеронизмом с артериальной гипертонией и гипокалиемией.
Ускоренная артериальная гипертония
Ускоренная артериальная гипертония характеризуется острым и значительным повышением диастолического давления. В ее основе лежит прогрессирующий артериосклероз. Концентрации ренина и альдостерона в плазме могут достигать очень высоких значений. Считается, что гиперренинемия и ускоренное развитие артериальной гипертонии обусловлены спазмами сосудов и обширным склерозом коркового вещества почек. Интенсивная гипотензивная терапия обычно устраняет спазмы сосудов и со временем приводит к снижению артериального давления.
Эстрогенная терапия
Заместительная эстрогенная терапия или прием пероральных контрацептивов могут увеличивать концентрацию альдостерона в сыворотке. Это обусловлено повышением продукции ангиотензиногена и, вероятно, ангиотензина II. Вторично возрастает и уровень альдостерона, но гипокалиемия при приеме эстрогенов развивается редко.
