Ревматоидный артрит сустава: что это такое, лечение, симптомы, диагностика, причины, признаки, стадии
Ревматоидный артрит представляет собой отличный пример вторичных заболеваний позвоночника.
Он затрагивает различные суставы и соединительные ткани спины и других частей тела. У организма развивается своего рода «аллергия» на эти ткани, в результате чего он начинает атаковать их специальными антителами. По этой причине подобные болезни и называются аутоиммунными: наша иммунная система восстает против нас самих.
Женщины страдают чаще мужчин в соотношении 3:1. Обусловлен генетическими факторами и влиянием окружающей среды. Воспаление синовиальной оболочки приводит к истощению/разрушению мягких тканей и суставного хряща. Системными проявлениями являются перикардит, васкулит, узелковое поражение легочной ткани, пневмосклероз и склерит. В процессе участвуют разные типы иммунных клеток: Т-лимфоциты, В-лимфоциты и макрофаги/моноциты. Повреждение обусловлено действием воспалительных цитокинов, особенно фактором некроза опухоли α (TNFα) и интерлейкином 1β (IL-1β).
Исход заболевания зависит от ранней постановки диагноза и своевременно начатой патогенетической терапии, что предупреждает прогрессию деструктивных изменений в пораженных суставах и развитие системности процесса. Хотя гистологически подтвержденный синовит не входит в критерии диагностики РА, синовиальная оболочка (СО) является важным объектом исследования как в процессе диагностического поиска, так и для изучения патогенеза ревматоидного процесса.
Причины ревматоидного артрита
РА — хроническое воспалительное заболевание, поражающее синовиальную оболочку и приводящее к повреждению сустава и разрушению (деструкции) прилегающей кости. Пик возраста начала заболевания приходится на пятое десятилетие, и женщины в 2-3 раза чаще подвержены развитию РА, хотя с возрастом половое распределение становится менее значимым. РА приводит к инвалидизации и значительно влияет на продолжительность жизни: пациенты с РА живут в среднем на 3-10 лет меньше, чем лица без него. Средний уровень заболеваемости составляет 20-50 случаев на 100 000 населения в год. Он снижается с 1960-х гг. Распространенность в разных странах различна:
- 0,5-1,1% в Северной Европе и Северной Америке;
- 0,3-0,7% в Южной Европе и других жарких странах;
- 0,5% в развивающихся странах.
В доклинической стадии РА возможно повышенное содержание IgG и может быть выявлен РФ (поликлональные AT к Fc-фрагменту IgG) и AT к ЦЦП (анти-ЦЦП-АТ). Цитруллинизация — модификация аргинина после трансляции с помощью пептидиларгинин-дезаминазы. В этой ранней стадии заболевания специфическая базисная терапия не показана.
Влияние генетических факторов при ревматоидном артрите
Значение генетических факторов подтверждается данными семейных исследований: распространенность заболевания составляет 2-12% среди родственников больных РА первой линии, что примерно в 10 раз выше, чем в общей популяции. Уровень конкордантности составляет 10-30% у монозиготных близнецов и 5-10% у однополых дизиготных близнецов. Генетический компонент РА изучают в анализах геномных связей и путем исследования отдельных генов кандидатов. Основной ген, чувствительный к РА, — DRBl-тен, расположенный в области хромосомы 6р II класса комплекса гистосовместимости. Риск РА связан с аллелями HLA-DRB1*0401, DRB1*0404, DRB1*0405, DRB1 *0408, DRB1*0101 и DRB1*0102. Эти аллели имеют похожие или одинаковые последовательности в третьей гипервариабельной области в β-цепи между аминокислотами в позиции 70 и 74. Согласно гипотезе двух различных эпитопов, данная последовательность прямо вовлечена в иммунопатогенез РА, хотя точный механизм не установлен.
HLA составляют примерно 30% генетического риска. Аллели предрасположенности к РА представлены почти у 70% пациентов, но также и у 40% лиц общей популяции. Таким образом, генотипирование неприемлемо в клинической практике. Другие гены, связанные с РА, включают:
- ген ФНО-α, расположенный во II классе комплекса гистосовместимости на хромосоме 6р. Полиморфизм влияет на уровень экспрессии ФНО-α;
- ген рецептора типа 2 к ФНО-α, расположенный в хромосоме 1р36. Аллель 196Р данного гена связана с РА;
- пептидиларгинин-дезаминаза также расположена в хромосоме 1р36. Эти ферменты катализируют цитруллинизацию остатков аргинина и, следовательно, определяют концентрацию цитруллиновых пептидов;
- SLC22A4 (растворенный семейный переносчик 22 А4), расположенный на хромосоме 5q31, также вовлечен в развитие болезни Крона;
- PTNP22 (тирозин фосфат нерецепторный типа 22) на хромосоме 1р13 также вовлечен в развитие сахарного диабета I типа и аутоиммунного заболевания щитовидной железы.
Факторы окружающей среды
Эти триггеры могут начать действовать задолго до появления клинически выраженного заболевания. Доклиническая стадия РА может длиться до 15-20 лет. На протяжении этой стадии распространенность маркеров аутоАТ повышается среди предрасположенных лиц с приближением дебюта заболевания. IgA РФ, вероятно, служат первыми маркерами у большинства пациентов. Ни РФ, ни анти-ЦЦП-АТ не считают абсолютно чувствительными, но вместе они вполне специфичны: от 85 до 90% для РФ и 98% для анти-ЦЦП. Маркеры воспаления, включая общий IgG, СОЭ и СРБ, могут быть повышены в течение клинической стадии. У пациента возможны симптомы недомогания и усталости и преходящие суставные симптомы (палиндромный ревматизм).
Триггеры окружающей среды могут быть важнее генетических факторов. Некоторые исследования показали более высокую связь этих триггеров по сравнению с семейными факторами, но трудно отделить генетические факторы от социальных и других факторов окружающей среды.
Курение, вероятно, служит наиболее сильным триггером окружающей среды; риск развития РА у курильщиков выше в 2-4 раза. Наблюдают дозозависимость: у тех, кто выкуривает очень большое количество сигарет, риск выше, чем у тех, кто курит мало. В формировании связи между курением и РА могут участвовать несколько механизмов: иммуномодулирующий эффект компонентов табака, окислительный стресс и эстрогенные эффекты, а также эффект влияния курения на усиление цитруллинизации пептидов. Курение повышает также риск развития СКВ с положительными антидвуспиральными-ДНК-АТ (анти-дсДНК-АТ). Курение сопровождается развитием более тяжелых форм ревматических заболеваний: эрозивной артропатии, ревматоидных узелков и васкулита. The Nurses Health Study (исследование по изучению здоровья медицинских сестер) было крупным когортным исследованием, изучившим эффект влияния аспирина и витамина Е на профилактику заболеваний сердца. В проспективном исследовании 103 818 женщин из этой когорты, наблюдавшихся с 1976 по 2002 г., было 680 новых случаев РА. Женщины со стажем курения 10 лет и более имели повышенный риск; риск РА был связан с частотой и продолжительностью курения. Повышенный риск существовал на протяжении 20 лет после прекращения курения.
Эстрогены у женщин оказывают защитное действие. Это обусловливает повышенный риск развития заболевания после менопаузы и слабый защитный эффект применения ГЗТ. Неясно, почему распространенность РА настолько высока у женщин по сравнению с мужчинами. Как и для других аутоиммунных заболеваний, защитным эффектом характеризуют беременность: заболеваемость во время беременности на 70% ниже, чем в контрольной группе, сопоставимой по полу и возрасту. Однако существует ответное повышение заболеваемости после беременности, риск развития РА в 5 раз выше в первые месяцы после родов. Кормление грудью, вероятно, также повышает риск развития РА. Это может быть связано с низким содержанием эстрогенов или провоспалительными эффектами пролактина. Наблюдают сложную связь между содержанием половых гормонов и предрасположенностью к аутоиммунным заболеваниям.
По-видимому, влияние социального статуса, работы и образования при РА невелико. Заболевание более распространено среди городского населения, но это частично может быть связано с миграцией пациентов с хроническим РА в крупные города. Работники определенных профессий имеют повышенный риск РА: мужчины, работающие в сельском хозяйстве и в бумажной промышленности, транспортном производстве, женщины, работающие в печати и на почте. У рабочих, контактирующих с кварцевой пылью (например, при бурении или дроблении горных пород), риск в 3 раза выше. Отмечено, что воздействие минеральных масел повышает риск развития ряда аутоиммунных заболеваний, включая РА.
Низкое потребление фруктов и витамина С приводит к повышенному риску, в то время как высокое потребление красного мяса несет высокий риск развития РА. Регулярное потребление рыбьего жира (источника ω3-жирных кислот) обладает защитным действием при строгом соблюдении средиземноморской диеты. Низкое содержание витамина D, по-видимому, служит фактором риска развития РА, но нет доказательств, что добавление витамина D в рацион питания препятствует развитию заболевания. Некоторые иммуноопосредованные заболевания, особенно сахарный диабет I типа и рассеянный склероз, более характерны для широт, где отмечают низкое воздействие ультрафиолетового света, что объясняют как содержанием витамина D в организме, так и другими метаболическими факторами.
Вызывают интерес данные об инфекционном триггере при развитии РА. Доказательство этого включает снижение частоты заболевания и связи с предыдущими гемотрансфузиями и владельцами домашних животных. Доказательств сезонности заболевания нет. Среди возможных микроорганизмов рассматривают вирусы Эпштейна-Барр, краснухи, парвовирус и Borrelia burgdorferi. Из них сильнейшее доказательство существует для вируса Эпштейна-Барр, глико-протеин которого имеет перекрестную реактивность с различными эпитопами HLA-DRB1. Имеются данные о повышенной распространенности и содержании ДНК вируса Эпштейна-Барр в мононуклеарных клетках периферической крови и синовиальной жидкости пациентов с РА, зарегистрировано также, что вирус обладает иммуномодулирующими свойствами.
Результаты последних исследований
Два последних исследования объединили данные по Великобритании и Соединенным Штатам для того, чтобы показать, что существуют важные локусы предрасположенности в хромосомах 6q и 16р. По-видимому, существует взаимодействие этих локусов с HLA-детерминантами. Дальнейшее исследование этих генов в данных локусах поможет уточнить патогенез РА.
В недавнем шведском исследовании «случай-контроль» положительные результаты иммунного окрашивания на цитруллиновые пептиды были получены в клетках из бронхоальвеолярного лаважа у курильщиков. Более того, была отмечена сильная связь между статусом курения и наличием антицитруллиновых AT, выявлена положительная связь между антицитруллиновой аутоиммунностью и наличием различных эпитопов в области HLA-DR. У лиц, которые курили и имели двойные копии различных эпитопов HLA-DR, риск развития РА был повышен в 21 раз.
На модели РА у мышей дефицит эстрогена при оофорэктомии ускорил развитие артрита и привел к повышению титров РФ, анти-дсДНК и антиколлагеновых AT.
Периодонтит вызывают главным образом грамотрицательные анаэробы. Инфицирование этими микроорганизмами приводит к повышенному синтезу цитокинов, что поражает соединительную ткань слизистой оболочки и повышает резорбцию альвеолярной костной ткани зуба. Маротте (Marotte) и соавт. показали, что различные эпитопы HLA-DR коррелируют с повышенным разрушением периодонтальной кости. Более того, разрушение периодонтальной кости строго коррелирует с резорбцией костей запястья у пациентов с РА.
РА имеет значимую наследственную составляющую, но, возможно, не такую сильную, как считалось ранее. Наиболее сильное генетическое влияние оказывают различные эпитопы HLA-DRB1. Из известных триггеров окружающей среды курение — наиболее сильный. Женщины более предрасположены к развитию заболевания, и низкий уровень эстрогенов, по-видимому, повышает предрасположенность. Наличие РФ не считается абсолютно специфичным для заболевания, но в целом имеет высокую прогностическую ценность. AT выявляют у части общей популяции, их можно выявить при других аутоиммунных заболеваниях соединительной ткани. Длительная доклиническая стадия с положительными РФ и анти-ЦЦП AT, иногда со слабыми и различными симптомами, характерна для РА.
Диагностика ревматоидного артрита
Основными признаками являются симметричное вовлечение мелких суставов кисти и стопы с появлением утренней тугоподвижности, длящейся более 30 минут; повышение показателей С-реактивного белка и СОЭ. Положительный ревматоидный фактор определяется у 80% пациентов и не является диагностическим критерием. Антитела к циклическому цитрулиновому пептиду (анти-ЦЦП) являются очень специфичным показателем. Рентгенологически выявляются эрозии (рентген, УЗИ, МРТ), синовит выявляется при выполнении УЗИ и МРТ.
Существенную помощь в диагностическом алгоритме РА играют новые иммунологические показатели и инструментальные методы (УЗИ и МРТ). Большое значение имеет и морфологическое исследование СО, имеющей при РА специфические черты.
СО легко доступна для биопсии. Возможны три чрескожные малоинвазивные методики. Во-первых, наиболее доступна и безопасна слепая аспирационная биопсия СО коленного сустава, которая может проводиться в любом ревматологическом стационаре без специального технического оснащения и не требует значительных денежных затрат. Этот метод позволяет получить несколько кусочков из многих участков СО различных суставов.
Морфологические особенности ревматоидного синовита отражают закономерности повреждения тканей при РА и обусловлены иммунным воспалением. Отмечается гиперплазия и гипертрофия СО и ворсин. Связь между поражениями кроющих синовиоцитов и клетками интимы осуществляется цитокинами, выделяемыми лаброцитами, лимфоцитами и макрофагами. В первую очередь пролиферируют кроющие синовиоциты типа В, синтезирующие простагландин Е2 и имеющие сходство с фибробластами. Уже в начале заболевания в синовии начинается активный ангиогенез. В связи с выраженной васкуляризацией возможны кровоизлияния и отложения гемосидерина.
Для развернутой стадии заболевания характерна картина хронического пролиферативного процесса. Отмечается стирание границы между кроющими синовиоцитами и субсиновиальным слоем. С помощью электронной микроскопии выявляется очаговая пролиферация синовиоцитов не только типа В, но и типа А.
Следует отметить, что к дифференциально-диагностическим признакам ревматоидного синовита относятся:
- палисадообразное расположение кроющих синовиоцитов в результате их пролиферации;
- формирование ревматоидных узелков;
- значительное содержание макрофагов и бластных форм лимфоцитов в фазе высокой местной активности воспалительного процесса;
- выраженная диффузная лимфоцитарная инфильтрация субсиновиального слоя или формирование фолликулоподобных структур с герминативными центрами в фазе высокой местной активности воспалительного процесса как проявление эктопического иммуногенеза;
- ангиоматоз;
- продуктивные васкулиты.
Отражением высокой общей активности патологического процесса является преобладание экссудативного компонента воспаления, в частности отека, фибриноидных изменений, появление полиморфно-ядерных лейкоцитов, макрофагов. Снижение активности заболевания сопровождается нарастанием продуктивных изменений. Синовиальные клетки паннуса экспрессируют фенотип антигенпрезентирующих дендритных клеток (RFD1) и зрелых макрофагов (RFD7), которые не встречаются в нормальной СО. Выделяют клеточный и сосудистый его варианты. Встречаются бессосудистые очаги и участки с пролиферирующими сосудами. В местах врастания паннуса в хрящ видно большое количество тонкостенных сосудов. Хрящевая и костная ткани вокруг них резорбированы. В зонах краевых эрозий макрофаги и фибробластоподобные клетки проникают вглубь хряща.
Хрящ под паннусом истончен, с глубокими трещинами. Нарушаются его тинкториальные свойства. Отмечается неравномерная эозинофилия, а при окраске методом Ван-Гизона имеет место пятнистая пикринофилия. Выявляется значительное неравномерное уменьшение γ-метахромазии матрикса. Эти изменения обусловлены его пропитыванием белковыми массами и нарушением синтеза гликозамингликанов. Уменьшается клеточность суставного хряща, и увеличивается количество пустых лакун. Наряду с этим встречаются очаги с двух- и трехклеточными лакунами. В далеко зашедших случаях выявляется грубая деструкция хряща. Видны отторжение фрагментов ткани и участки обызвествления. Минерализация хряща считается особенностью его поражения при РА. Вслед за ней следует замещение хряща фиброзной и пластинчатой костью. Метахромазия почти полностью исчезает. Число хондроцитов резко снижено, большинство из них дистрофично или некротизировано.
Наиболее выраженные изменения костной ткани наблюдаются в периартикулярных отделах. Периостальные фибробласты пролиферируют и придают «изрытый» характер кортикальной поверхности кости. В субхондральной пластинке выявляются множественные эрозии, вызванные остеокластами, хондрокластами и мононуклеарами.
Прогрессирование процесса характеризуется выраженными деструктивными процессами, сочетающимися с дальнейшей деструкцией кости паннусом. Местами субхондральная костная пластинка полностью разрушена. Между ее остатками видны грануляционная и фиброзная ткани с очагами фибриноидного некроза, кисты и лимфоцитарная инфильтрация.
Специфическим морфологическим признаком РА являются ревматоидные узелки, встречающиеся у 1/4 больных и связанные с циркуляцией ревматоидного фактора и тяжелыми эрозиями суставов. Их можно увидеть в различных органах и тканях, но наиболее часто они обнаруживаются в коже на разгибательной поверхности суставов, а также на сухожилиях.
Узелок представлен тремя зонами:
- очагом фибриноидного некроза;
- палисадообразно расположенными удлиненными гистиоцитами с одним или более ядрами;
- периферически расположенными лимфоцитами, плазматическими клетками и пролиферирующими фибробластами.
Некроз имеет интенсивно розовый цвет при окраске гематоксилином, а при проведении реакции Маллори окрашивается в красный цвет. Нередко можно увидеть гигантские многоядерные клетки. В зависимости от «зрелости» узелка одна из зон может отсутствовать, так же как и многоядерные клетки. Иммуноморфологически в очаге некроза выявляют IgG, IgM, IgA и СЗ-фракцию комплемента. Эти данные подтверждают роль иммунопатологических реакций в их возникновении. В процессе формирования узелка также обсуждается роль микротромбозов и травм наряду с секрецией прокоагулянта и протеиназ активными макрофагами.
Наиболее часто сосудистые поражения имеют место в биоптатах кожи. В базальных мембранах выявляют IgG и СЗ-фракцию комплемента. В периваскулярных пространствах располагаются лимфогистиоцитарные инфильтраты различной степени выраженности. Коллагеновые волокна фрагментируются, и при специальных окрасках видны фибриноидные изменения и пикринофилия. Лейкоцитокла-стические васкулиты указывают на обострение процесса и необходимость активной терапии. При снижении активности заболевания наблюдается уменьшение, вплоть до исчезновения, структурных изменений дермы и сосудов микроциркуляторного русла.
При РА во внутренних органах развивается гломерулонефрит, пневмонит, гепатит, которые не имеют морфологических признаков нозологической специфичности.
Ревматоидный артрит осложняется АА-амилоидозом. Для диагностики АА-амилоидоза применяют биопсию слизистой оболочки ЖКТ, подкожной клетчатки и почки. Диагностическая значимость аспирата подкожного жира весьма высока и достигает 70-80%. В случае применения селективной окраски конго-красным массы амилоида выявляются в стенках сосудов, строме, мезангии и базальных мембранах канальцев почки. Для исключения ложноположительной реакции рекомендуется применять поляризационный микроскоп, где в темном поле массы амилоида имеют светло-зеленый цвет. Типирование АА-амилоида возможно с помощью иммуногистохимического исследования моноклональными антителами, при котором массы амилоида имеют коричневый цвет.
Лабораторные исследования и методы визуализации
Постановка диагноза «ревматоидный артрит»
Воспалительный артрит; установлено, что этот класс артрита относится к хроническим заболеваниям длительностью от 8 до 10 нед, что делает поствирусную артропатию маловероятной. Классификация РА (разработанная ACR) требует наличия не менее четырех из семи нижеперечисленных критериев с клиническими проявлениями артрита, по крайней мере, в течение 6 нед.
- Утренняя скованность, сохраняющаяся более 1 ч.
- Объективный признак воспаления сустава, такой как отек мягких тканей или выпот в 3-х и более определенных суставах.
- Артрит суставов кистей.
- Симметричный артрит, как минимум, одной группы.
- Ревматоидные узелки.
- Наличие РФ при использовании метода, который дает положительные результаты менее чем у 5% здоровых лиц.
- Типичные признаки РА на рентгенограммах суставов кисти и лучезапястных суставов, включающие эрозии или явную околосуставную остеопению.
РА — одно из наиболее частых аутоиммунных заболеваний, поражающее 1% населения. Другие заболевания, такие как ПсА или СКВ, могут проявиться такой же клинической картиной, и данные анамнеза и проведенного исследования позволят провести дифференциальную диагностику.
Исследования при ревматоидном артрите
РФ — поликлональные AT преимущественно классов IgM и IgG к Fc-фрагменту IgG. Хотя в большинстве случаев как врачи, так и пациенты считают, что РФ имеет диагностическое значение, его прогностическая ценность очень низка, его обнаруживают лишь у 70% пациентов с РА и также у 5% здоровых лиц. РФ-позитивность повышается с возрастом, и он положителен в любом случае при пролонгированной антигенной стимуляции, что объясняет большую долю положительных результатов РФ при хронических инфекциях (малярия, туберкулез). Подобным образом у отдельных пациентов с заболеваниями суставов возраст и сепсис необходимо учитывать в качестве причины положительного РФ при дифференциальной диагностике РА. РФ-позитивность ассоциирована с повышенной частотой эрозий суставов и васкулита.
Исторически рентгенографию кистей и лучезапястных суставов, стоп и шейного отдела позвоночника проводили в начале и затем 1-2 раза в год для наблюдения за развитием эрозивного поражения. К счастью, модель терапии изменилась, так что теперь ее целью стало как можно раннее после установления диагноза подавление воспаления; это обусловлено тем, что эрозии сустава, выявляемые при МРТ или УЗИ опорно-двигательного аппарата, наблюдаются примерно за 18 мес до их определения при простой рентгенографии. При дальнейшем течении заболевания могут быть различные признаки поражения, характерные для псориаза, СКВ и РА. Для псориаза характерны эрозии типа «карандаш в колпачке» в проксимальных и дистальных межфаланговых суставах, сужение проксимальных фаланг до «заостренного карандаша» с образованием чашеобразных расширенных дистальных фаланг. При СКВ почти всегда наблюдается неэрозивное поражение. Рентгенологические изменения при РА отображают клинически вовлеченные суставы, в первую очередь кисти: проксимальные межфаланговые, пястно-фаланговые и лучезапястные суставы. Отек мягких тканей наблюдается рано, наряду с околосуставной остеопенией, впоследствии отмечается симметричное сужение суставных поверхностей. Эрозии начинаются в месте перехода синовиальной оболочки в капсулу сустава, вдаваясь в соединения хрящ/периост, в связи с чем они наблюдаются немного дальше от суставной поверхности.
СОЭ и СРВ — маркеры острофазовых белков, вырабатываемых в печени в ответ на цитокины, выделяемые моноцитами. Определение активности СРБ более дорогостоящее, чем СОЭ, но СРБ — более предпочтительный показатель для контроля успешного подавления воспалительных процессов в суставе, особенно при РА. Более сложная ситуация складывается при СКВ, у некоторых пациентов цитокины приводят к повышению СРБ, у других же заболевание не сопровождается его повышением.
В мазке крови обычно выявляют воспалительный тромбоцитоз, при более стабильном течении заболевания обнаруживают нормохромную нормоцитарную анемию; со временем клиническая картина крови может имитировать картину гипохромной микроцитарной анемии при дефиците железа вследствие подавления утилизации запасов железа из-за воспаления. Сопутствующее применение таких препаратов, как НПВС, может вызвать истинную железодефицитную анемию вследствие потери крови через ЖКТ. Глюкокортикоиды вызывают нейтрофильный лейкоцитоз.
В клиническое обследование необходимо включать общий анализ мочи, при наличии протеинурии или лейкоцитов необходимо провести микроскопию и оценку результатов. Протеинурия предполагает воспаление клубочков. Если СКВ остается частью дифференциальной диагностики, может потребоваться тест на АНАТ. Значимым положительным результатом считают титр 1:160 или выше, и опять же в отдельности он имеет малую диагностическую или прогностическую ценность, если не рассматривается как часть клинической картины. Необходимо определить содержание электролитов в крови, функциональное состояние почек и печени. НПВС могут усилить гиперкалиемию и нарушить функцию почек, а некоторые базисные болезнь-модифицирующие препараты способны вызывать гепатит с повышением активности трансаминаз.
Контроль безопасности приема препаратов при ревматоидном артрите
Метотрексат, один или в комбинации с другими препаратами, служит основой большинства схем лечения РА. У лиц, не отвечающих быстро на «стандартную» терапию, все чаще используют биологические препараты, направленные на специфические цитокины, такие как ФНО и ИЛ-1, или те которые блокируют сигнал от клетки к клетке [например, цитотоксичный Т-лимфоцит-ассоциированный Аг 4, связанный с иммуноглобулином (CTLA4-Ig; абатацепт)]. Рекомендуют проведение скрининга на гепатиты В и С, хотя положительный результат не служит абсолютным противопоказанием для терапии. Последние исследования свидетельствуют об усилении противовирусного действия препаратов интерферона (ИФН) и рибавирина при сочетании с этанерцептомр при гепатите С.
Взаимодействие врачей узких специальностей с врачами общей практики
Необходимы тесное сотрудничество и четкий обмен документацией. Пациенткой и ее врачом должен быть разработан план ведения, но большую часть этого плана будет осуществлять врач общей практики. Необходимо учитывать, что любое новое заболевание будет влиять на ведение РА, а ведение РА, в свою очередь, будет влиять на ведение сопутствующих заболеваний и на такие профилактические действия, как вакцинация. Неясно, кто будет делать назначения и кто будет их контролировать, связываться с поциентом по поводу любого показателя, выходящего за пределы нормы, определяемого при периодическом скрининге. Необходимо рекомендовать посещать своего врача общей практики регулярно, что в конечном итоге должно позволить осуществлять периодические визиты к двум врачам, с посещением специалиста 4-6 раз в месяц.
Результаты последних исследований
Определение AT к ЦЦП имеет чувствительность, подобную РФ, но специфичность намного выше — на уровне 95-99%. У пациентов с ранним недифференцированным артритом при обнаружении анти-ЦЦП AT риск последующего развития РА возрастает в 38 раз и служит плохим прогностическим маркером как клинической картины заболевания, так и рентгенологического прогрессирования. Повторное определение AT не имеет клинического значения, так как терапевтическое воздействие приводит только к умеренному снижению их значений, но не коррелирует с клиническими показателями.
Лечение анти-ФНО-препаратами защищает от повреждения сустава, но может оказывать небольшое влияние на маркеры системного воспаления, такие как СОЭ и СРВ. Высокочувствительное определение СРВ может дать специфичные значения, более низкие, чем предыдущее пороговое значение у лиц с РА при нормальном уровне СРВ; у лиц со значениями СРВ 2-8 мг/л (при высокочувствительном тесте) были более высокие баллы по шкале активности заболевания, реже выявлялась ремиссия и была выше частота депрессии и беспомощности, чем у пациентов с СРВ менее 2 мг/л. Высокочувствительное определение СРВ также лучше, по сравнению с СОЭ, предсказывает изменение других параметров активности заболевания. Неудивительно, что число пораженных суставов у пациента служит хорошим маркером активности и дальнейшего прогноза заболевания. У лиц с ранним артритом с продолжительностью менее 1 года число пораженных суставов более 7 точно предсказывало последующее системное проявление и нарушение функционального состояния.
В исследованиях по биологической терапии проводят детальную рентгенологическую визуализацию и оценку, которая свидетельствует, что прогрессия может быть остановлена и что эрозии сустава могут исчезать в связи с повторным ростом и заполнением кортикального слоя кости. Обзорная рентгенограмма кистей и стоп остается быстрым и доступным способом визуализации, но эрозии могут быть выявлены более чувствительными методами примерно за 18 мес до того, как они появятся на обзорных снимках. Методы визуализации, которые можно для этого использовать, включают УЗИ, МРТ и КТ. Большинство эрозий в лучезапястном суставе будут определены как при КТ, так и при МРТ, хотя КТ выявит больше эрозий, особенно в основании пястных суставов, вероятно, из-за способности КТ разграничивать кортикальный край кости. УЗИ высокого разрешения требует хорошего контакта и возможности доступа к поверхности кости. Таким образом, исследования лучезапястного сустава недостаточно; для II и IV пястно-фаланговых суставов выявлена лучшая корреляция с данными МРТ, чем с данными УЗИ III и IV пястно-фаланговых суставов, которое можно выполнить только в двух плоскостях.
Необходимо четко разъяснить пациенту необходимость проведения методов исследования, которые помогут подтвердить диагноз и определить активность заболевания и влияние на функциональное состояние. Совместное наблюдение специалистом и врачом общей практики направлено на подавление воспалительного процесса, что останавливает местное и системное влияние заболевания. Участие в лечении с самого его начала полезно для понимания пациентом стратегий, которые вы используете для контроля заболевания. Основная цель заключается в достижении абсолютного минимума числа болезненных и опухших суставов, снижении маркеров воспаления и улучшении качества жизни пациента. Противоревматические препараты высокоэффективны в контроле заболевания. Необходимо обсуждать с пациентом любое новое лекарственное средство для ясного понимания полезных эффектов и возможных побочных реакций (отдельно обсуждаются в контексте того, как их минимизировать и как их можно определить на ранних сроках). РА остается хроническим, пока что неизлечимым заболеванием, которое все же лечат с использованием все более увеличивающегося числа методов и гибкой системы для поддержания высокого качества жизни практически у всех пациентов.
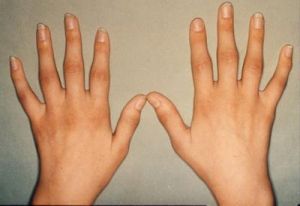
Признаки и симптомы ревматоидного артрита
- У больных с ревматологическими заболеваниями чаще всего поражаются запястье и кисть
- Типичны деформации запястья, пальцев и первого пальца
- Боль и утрата функции могут привести к потере трудоспособности
- Часто эффективно медикаментозное и хирургическое лечение
- Системное воспаление приводит к остеопорозу, снижению продолжительности жизни и повышенной частоте сердечно-сосудистых заболеваний. Возможна непреодолимая усталость.
Лечение ревматоидного артрита
Для контроля течения РА требуется длительное ведение пациентов, основанное не только на лекарственной терапии, но и на немедикаментозных подходах, таких как физиотерапия и психосоциальная реабилитация. Медикаментозное лечение РА до сих пор проблематично, и не существует желаемой терапии, исцеляющей или приводящей к ремиссии, хотя с появлением биологических препаратов были достигнуты определенные успехи. Однако РА часто прогрессирует и приводит к инвалидности. Есть надежда, что использование старых базисных противоревматических препаратов (БПРП) в полном объеме вместе с более новыми БПРП и биологическими препаратами может улучшить данный прогноз. Медикаментозная терапия первой линии при всех воспалительных заболеваниях включает НПВС. Они оказывают симптоматическое действие, но не влияют на прогрессирование РА, и всем пациентам необходимо дополнительное лечение БПРП.
Добавление ω3-жирных кислот
Воспаление играет роль в развитии некоторых острых и хронических заболеваний человека и характеризуется образованием воспалительных цитокинов, эйкозаноидов из арахидоновой кислоты (простагландины, тромбоксаны, лейкотриены), активных форм кислорода и молекул адгезии. Длинноцепочечные ω3-жирные кислоты (эйкозапентаеновая кислота и докозагексаеновая кислота) обладают противовоспалительными свойствами при приеме доз, превышающих 2,7 г ежедневно; доказана их эффективность при РА, они снижают утреннюю скованность, число болезненных суставов и уменьшают необходимость приема НПВС.
При достаточно высоком потреблении длинноцепочечных ω3-полиненасы-щенных жирных кислот, обнаруженных в жирных сортах рыбы и рыбьем жире, снижается образование воспалительных эйкозаноидов, цитокинов и активных форм кислорода, уменьшается экспрессия молекул адгезии. Длинноцепочеч-ные ω3-полиненасыщенные жирные кислоты действуют прямо (например, путем замещения арахидоновой кислоты субстратом эйкозаноида и угнетения метаболизма арахидоновой кислоты) и опосредованно (например, путем нарушения экспрессии генов воспаления посредством фактора активации транскрипции). Длинноцепочечные ω3-полиненасыщенные жирные кислоты также служат источником резолвинов, семейства противовоспалительных медиаторов. Необходимая доза ω3-рыбьего жира может быть получена при приеме большого числа капсул рыбьего жира [ежедневно более 9 стандартных капсул рыбьего жира, содержащих жир из потрошеных рыб (30% ω3-жирных кислот)]; однако стоимость такой добавки может быть очень высокой. Менее дорогостоящей альтернативой служит прием 10-15 мл бутилированного рыбьего жира в сутки. Вкусовые качества и соответственно длительный прием рыбьего жира могут быть улучшены с помощью следующего способа. Необходимая доза рыбьего жира «плавает» в 30 мл фруктового или овощного сока в маленьком стакане. Содержимое стакана нужно пить без контакта с губами, что препятствует ощущению вкуса рыбьего жира. Затем маленькими глотками медленно выпить 40 мл сока (из другого стакана) для полоскания полости рта. Обратного заброса рыбьего жира можно избежать, если принимать его сразу перед приемом твердой пищи и без дополнительного объема жидкости (это способствует смешиванию рыбьего жира с пищей и перехода его в таком виде из желудка в тонкую кишку). Пассаж жира из желудка можно также ускорить, если лежать на левом боку в течение 15 мин после приема дозы или путем дробления ежедневной дозы, принимая половину дозы сразу перед завтраком и ужином.
Базисные противоревматические препараты
Недавнее изменение стратегии использования БПРП заключается в том, что их рекомендуется применять вскоре после постановки диагноза, чтобы получить максимальный эффект замедления прогрессирования заболевания. Необходимость раннего начала терапии обусловлена доказанными фактами формирования костных эрозий и нарушением функции суставов уже в первые 2 года заболевания. Данный подход противоположен старым режимам ведения пациентов с РА, при которых БПРП назначали только при появлении эрозий костей на рентгенограммах суставов.
Препаратами первого выбора при лечении РА служат метотрексат, лефлуномид и сульфасалазин. Метотрексат — «золотой стандарт» БПРП с дозами, повышаемыми до 20 мг/нед в течение 6-8 нед, и добавлением фолиевой кислоты 5 мг/нед. Необходимо записывать объективные исходы, включая число припухших и болезненных суставов, маркеры воспаления (СОЭ, СРВ) и качество жизни/функциональный индекс. Неудачная попытка достижения ремиссии заболевания после 3-4 мес лечения (максимально) должна быть основанием для расширения или смены схемы лечения.
Многим пациентам с РА и другими воспалительными заболеваниями суставов также назначают низкие дозы глюкокортикоидов внутрисуставно и/или внутрь. Их часто используют как промежуточную (bridge) терапию, пока не будет полностью достигнут эффект БПРП. У некоторых пациентов их применяют длительное время с БПРП для удовлетворительного подавления активности заболевания. Можно также использовать глюкокортикоиды отдельно для контроля заболевания у лиц пожилого возраста, если контроля можно достичь ежедневным приемом дозы, эквивалентной 7,5 мг преднизолона или менее.
Биологические препараты
Они представлены ингибиторами цитокинов, чаще ФНО, ИЛ-1 и др. Эти препараты обеспечивают быстрый контроль РА в большом числе случаев, тормозя деструкцию суставов, которая у части больных может претерпевать обратное развитие. Однако существуют потенциальные проблемы, связанные с биологическими препаратами, особенно активация инфекций, а также очень высокая стоимость этих препаратов.
Самым последним способом оптимизации лечения РА стало внедрение первичной комбинированной терапии. Данный подход основан на опыте онкологов, которые используют комбинацию препаратов с различным механизмом действия, что приводит к дополнительному или синергическому эффектам, без существенного повышения токсичности. Исследования, при которых одна группа получает глюкокортикоиды в дозах от промежуточных до высоких, демонстрируют клинический эффект, но он становится менее значимым после снижения дозы или отмены препарата. Интересно, что в этих исследованиях отмечено рентгенологическое улучшение, которое продолжалось в течение нескольких лет, свидетельствуя о том, что у ряда больных первичный быстрый ответ на лечение включал клинико-лабораторное улучшение в сочетании с замедлением структурных нарушений при их наличии.
Обучение пациента
Считают, что обучение пациента помогает ему эффективно справляться с заболеванием и содействует комплексному лечению. Внимание направлено на обучение пациентов адаптации к их ежедневной активности, обусловленной симптомами заболевания. В дополнение к обучению пациентов тому, что они должны делать, их также инструктируют, как пытаться справиться с ситуациями и делать соответствующие поправки индивидуально для себя и своих нужд. Однако неясно, какие образовательные методы наиболее эффективны в улучшении состояния здоровья пациентов с хроническим заболеванием. Систематический обзор РКИ изучил влияние обучения пациентов на боль, функциональную нетрудоспособность, число пораженных суставов, общую оценку пациентом и врачом, на баллы и маркеры острой фазы. Качество исследований было определено как не очень высокое, в частности, возникали вопросы по рандомизации. При первом наблюдении существует малый, но значимый полезный эффект, особенно относительно функциональной нетрудоспособности. Величина эффекта мала, но подобна получаемому эффекту при применении слабых БПРП. Продолжительность эффекта также короткая, заканчивается при наблюдении после 3-14 мес. Именно поэтому необходимо изучать пути сохранения и расширения первичных полезных эффектов обучения в течение более продолжительного времени.
Клинический ответ на лечение РА можно оценить с помощью расчета доли пациентов, имеющих улучшение на 70% и более по 7 клиническим и лабораторным показателям активности заболевания; это расценивается как ответ на 70% по критериям ACR (ACR-70). Ответы ACR-70 были у 19-21% пациентов, получавших монотерапию метотрексатом в исследованиях при раннем РА, и у 33-40% лиц, получавших ингибиторы ФНО с метотрексатом. При установленном РА ответы ACR-70 были у менее 5% пациентов, получавших монотерапию метотрексатом, но у 10-27% тех, кто получал комбинированную терапию. Ингибиторы ФНО значительно снижают эрозивное повреждение, оцениваемое по данным рентгенографии и МРТ. Они также снижают степень нетрудоспособности, оцениваемую пациентами самостоятельно с помощью вопросника по оценке здоровья, и улучшают качество жизни, определяемое по вопроснику SF-36.
Курение остается самым важным фактором риска и модифицируемым фактором образа жизни. У мужчин в 3 раза выше вероятность развития РА, если они курят; риск увеличивается в 13 раз у заядлых курильщиков обоих полов (41-50 блоков в год). Влияние курения значительно выше у лиц с фоновым наличием генетической предрасположенности в виде различных эпитопов HLA-DRB1. Прекращение курения может снизить этот риск, хотя полезный эффект не наблюдается, пока не пройдет 10 лет после отмены, когда повышенный риск уменьшится в 2 раза.
Ранняя диагностика РА и быстрое подавление заболевания с помощью БПРП и преднизолона — ключевой момент первоначального улучшения качества жизни пациента и сведения к минимуму последующего прогрессивного повреждения суставов. Метотрексат сохраняет свою ключевую роль в раннем лечении РА, и до сих пор преимущества комбинированной терапии остаются скорее противоречивыми, чем неоспоримыми, хотя некоторые исследования подтверждают последнее. Одно из лучших доказательств, подтверждающих эффективность комбинированной терапии, касается блокаторов ФНО, когда их сочетают с метотрексатом; их комбинация превосходит по эффективности монотерапию любым другим препаратом относительно клинического, функционального и рентгенологического аспектов. Основное достижение — стратегия, направленная на жесткий контроль заболевания с быстрой сменой режимов лечения, если состояние пациента не улучшается при оценке определяемого и регистрируемого исхода. Литературные данные также свидетельствуют о том, что добавление к БПРП преднизолона в дозе от промежуточной до высокой, в режиме как монотерапии, так и комбинированной терапии, полезно, если выполняется в ранней стадии РА.
Оценка лечения
Польза любого терапевтического вмешательства должна превышать его стоимость; стоимость проще всего оценивать в денежном эквиваленте. Труднее всего оценить, актуальна или потенциальна стоимость для индивидуального лица относительно удобства применения, мониторинга и побочных эффектов. Подобно этому во многих случаях бывает трудно оценить полезный эффект, и это особенно характерно для ревматических заболеваний, при которых серьезная конечная точка, такая как смерть, редко служит показателем исхода. У пациентов с РА наблюдают боли и нарушение функции, но со временем пациенты адаптируются к этим условиям и повреждениям, связанным с симптомами, таким образом, потеря функциональной активности происходит медленно и не сопровождается жалобами со стороны пациента. РА и АС представляют собой противоположные заболевания.
Показатели исхода различаются в зависимости от ситуации и целей, для которых их оценивают, часто значительно при использовании в рутинной клинической практике и в клинических исследованиях. Необходим практичный подход, если их применяет среднестатистический практикующий врач, у которого или нет специальных знаний, или есть недостаток специального оборудования. В широком понятии при РА различают следующие исходы.
- Лабораторные признаки воспаления, выраженные в виде СОЭ и СРБ.
- Клинически очевидное воспаление суставов, зарегистрированное по числу болезненных или отечных суставов при обследовании.
- Клиническое исследование функционального состояния позвоночника.
- Жалобы пациентов на боль, усталость или функциональные последствия их заболевания.
- Рентгенологическая прогрессия.
Лабораторные показатели активности заболевания
Результаты лабораторных исследований сами по себе могут вводить в заблуждение. Нередко человек имеет нормальные величины маркеров воспаления, несмотря на небольшое число воспаленных периферических суставов, при этом повышенные значения маркеров могут быть обусловлены сопутствующим заболеванием, таким как инфекция мочевых путей. РА с его явным воспалением синовиальных оболочек часто приводит к повышению маркеров воспаления, в то время как для спондилоартропатии (преобладает воспаление энтезиса на поверхности между сухожилием и периостом) характерны намного меньшие и часто нормальные их значения.
Физическая оценка активности заболевания
Подсчет числа болезненных и отечных суставов — быстрый и простой способ как обследования пациентов, так и оценки степени активности их заболевания. При возможности обследовать каждый сустав было показано, что изучение легкодоступных 18 суставов на верхних конечностях и коленных суставов достоверно показывает активность заболевания. Метод обследования заключается в пальпации сустава в двух направлениях, с достаточным давлением (побеление дистальной трети ногтя большого пальца кисти врача) для определения в отдельности отека и болезненности. Число болезненных суставов (ЧБС) и число опухших суставов (ЧОС) можно записать в истории болезни и в направлениях к другим врачам (т.е. ЧОС = 4/18, ЧБС = 6/18). Эти показатели позволяют проводить быстрый анализ динамики заболевания, а также служат маркерами абсолютной тяжести болезни. Число от 6 до 8 указывает на умеренную активность заболевания, достаточную для участия пациента во многих исследованиях новых терапевтических средств.
Оценка функционального состояния позвоночника требует более полного обследования и воздействия на пациента, но приводит к ряду показателей, которые достоверны в определении прогрессивного снижения функции и потенциально действуют как мотивация относительно выполнения текущей программы физических упражнений. Показатель подвижности позвоночника — Британский метрологический индекс AC (BASMI) — представляет собой балл относительной тяжести для любого исхода и позволяет провести периодическое сравнение. Способность разъяснить пациенту суть прогрессирования течения его заболевания важна, и это может служить мотивацией для согласия пациента на лечебные воздействия, особенно на физические упражнения и физиотерапию.
Оценка качества жизни
Врачи признали, что они не могут вылечить многих пациентов, но цель лечения заключается в улучшении их качества жизни. Это понятие имеет много областей, и на практике врачи первично нацелены на области, которые связаны со здоровьем человека, оказывающие влияние на общее самочувствие, — так называемое связанное со здоровьем качество жизни. Даже внутри этой области существуют инструменты, оценивающие ее стандартным способом, что позволяет применить его в сравнительном аспекте при различных заболеваниях, что может использоваться при распределении средств здравоохранения. Существуют и специфичные для конкретного заболевания методы, обычно они используются для оценки эффективности различных методов лечения.
Важным симптомом, выявленным у пациентов с РА и АС, стала утомляемость. В отличие от нормальной усталости, утомляемость представляет собой хронический симптом и обычно не связана с чрезмерной нагрузкой и не проходит после отдыха. Утомляемость — частая жалоба при многих хронических заболеваниях, ее можно оценить с помощью визуально-аналоговых шкал и специальных опросников. В качестве исхода она имеет четкую связь с другими суставными симптомами при РА и АС; нарушения сна отрицательно влияют на утомляемость. Регулярная физическая активность помогает уменьшить утомляемость и улучшить качество жизни.
Существуют противоречивые данные относительно выживаемости пациентов с АС. Крупное популяционное исследование, проведенное в Рочестере, штат Минессота, не показало различий в уровне смертности мужчин с АС и в общей популяции. Другие исследования показывают, что смертность выше (стандартизированный коэффициент смертности 1,7) среди пациентов с АС, наблюдавшихся в специализированных центрах, и что имеется линейная связь между смертностью и тяжестью заболевания. Более того, смертность при АС может быть связана с продолжительностью заболевания. ОР смерти в общей популяции мужчин составляет 4,0 для желудочно-кишечных заболеваний, 1,3 — для сердечно-сосудистых заболеваний и 1,2 — для цереброваскулярных заболеваний. Курение представляет собой дозозависимый фактор риска развития атеросклероза, но неизвестно, курят ли пациенты с АС больше, чем в общей популяции. Однако курение ассоциировано с более плохими клиническими, функциональными и рентгенологическими исходами при АС.
Воспалительные процессы при АС могут повлиять на различные структуры сердца; наиболее часто встречаются нарушения проводимости и недостаточность аортального клапана и реже всего — перикардит, кардиомиопатия и поражение митрального клапана. Нарушения проводимости могут наблюдаться при АС вследствие воспаления и фиброза межжелудочковой перегородки и, следовательно, поражения атриовентрикулярного узла. Недостаточность аортального клапана развивается вследствие воспалительного процесса, поражающего стенку аорты, сразу рядом или выше синусов аорты. Это приводит к рубцеванию, фиброзу, утолщению и укорочению створок аортального клапана, расширению корня аорты и в результате к регургитации. Частота нарушений проводимости у пациентов с АС варьирует от 1 до 33%, недостаточности аортального клапана — от 1 до 10%, и частота повышается с возрастом, продолжительностью заболевания и наличием периферического артрита. Нарушение расслабления желудочка, приводящее к диастолической дисфункции, все чаще определяется при АС, даже у пациентов с клинически легким течением заболевания. Уилдирир (Yildirir) и соавт. обследовали 88 пациентов с АС и 31 человека из группы контроля и выявили, что у пациентов с АС, по сравнению с контрольной группой, была значительно нарушена диастолическая функция левого желудочка.
В клинической практике рекомендуют оценивать три области терапевтических ответов при РА: сообщаемые пациентом показатели физического функционирования и/или общей активности заболевания; сообщаемые врачом показатели физического функционирования и/или общей активности заболевания; и визуализацию кистей и/или стоп 2 раза в год. В практике можно использовать 10-сантиметровую визуально-аналоговую шкалу как пациентом, так и врачом для определения общей активности заболевания. Рентгеновские снимки следует сравнивать с течением времени, может потребоваться помощь местного рентгенолога. У каждого пациента необходимо определять показатели улучшения индивидуальной физической активности.
Существует диапазон практических и относительных показателей для оценки значимых исходов у пациентов с артритом, особенно при АС и РА. Они комбинируют лабораторные, объективные клинические и субъективные показатели со стороны врача и пациента для получения многосторонней оценки, предоставляющей информацию по текущей активности заболевания и его влиянию на качество жизни пациента, и позволяют вам оценить пользу лечебных мероприятий, которые получает пациент.
Медикаментозное лечение
Инъекции кортизона
Внутрисуставное или парасухожильное введение. Уменьшает воспаление.
Может быть введен неоднократно.
Шинирование
- Фиксация болезненного или деформированного сустава (например, шинирование запястья).
- Постепенная коррекция или, по крайней мере, предупреждение прогрессирования деформации (шина для коррекции локтевой девиации)
- Послеоперационное шинирование, например, динамическое шинирование после эндопротезирования пястно-фаланговых суставов, гипс до сращения кистевого сустава и т.д.
Терапия кисти
Используют методы защиты сустава, чтобы уменьшить боль, предупредить деформацию и сохранить амплитуду движений. Принципы лечения:
- Избегать болезненных движений
- Использовать более крупные/здоровые суставы
- Распределять нагрузку на несколько суставов
- Сократить усилия до минимума
- Избегать силовых захватов
- Избегать деформирующих положений
- Стабилизировать суставы
Обучение:
- По состоянию
- Самообслуживанию
- Регуляции
- Определению приоритетов
- Организованности
Повседневная активность:
- Определение области затруднений
- Усиление защиты суставов использованием альтернативных приемов
- Обеспечение адаптирующими приспособлениями
- Направить в агентство по обслуживанию на дому
Упражнения:
- Для сохранения амплитуды движений
- Предупреждения деформации
- Гидротерапия
- Парафин
Лекарственные препараты
Симптоматические
- Анальгетики
- Противовоспалительные
Модифицирующие заболевание
- Кортикостероиды
- Метотрексат (препарат выбора из болезнь-модифицирующих противоревматических препаратов)
- Сульфасалазин
- Золото (теперь редко)
- Пеницилламин (теперь редко)
- Биологическая терапия
Принципы хирургического лечения
Показания
- Устранение активного синовита, не поддающегося медикаментозному лечению
- Снятие болевого синдрома, сохраняющегося при консервативном лечении
- Коррекция сформировавшейся деформации
- Улучшение функции (например, разрыв сухожилий, разболтанность первого пястно-фалангового сустава и т.д.)
- Прекращение прогрессирования деформации (например, раннее лечение локтевой девиации путем коррекции угла наклона лучевой кости в кистевом суставе и восстановление правильного положения мягких тканей на уровне пястно-фаланговых суставов; удаление головки локтевой кости для профилактики разрыва сухожилий)
- Косметические показания (появление локтевой девиации в пястно-фаланговых суставах и выраженная деформация пальцев могут вызывать обеспокоенность).
Сначала запястье, затем пястно-фалантовые суставы
Операции на кистевом суставе должны чаще всего предшествовать операциям на пястно-фаланговых суставах. Например:
Коррекция лучевой девиации кисти может улучшить положение пальцев в пястно-фаланговых суставах при их локтевой девиации.
Условия реабилитации нарушения положения в пястно-фаланговых суставах противоречат условиям реабилитации после реконструкции сухожилий разгибателей на уровне запястья.
Анкилоз кистевого сустава устраняет эффект тенодеза, способствующий движениям в пястно-фаланговых суставах.
Функциональные требования
У некоторых пациентов с ревматоидным артритом удовлетворительная функция верхней конечности, ухудшаемая одной или двумя специфическими проблемами. С помощью хирургической коррекции (например, артродеза кистевого сустава, стабилизации первого пальца) обеспечивается значительное улучшение функции.
В других случаях возможны серьезные проблемы с функцией верхней конечности. Медикаментозная терапия и терапия кисти играют большую роль. Однако, при выраженном снижении функции возможно получение приемлемых результатов после операции у больных с тяжелой степенью заболевания, хотя они могут быть неопределенными (Darrach, эндопротезирование локтевого сустава, эндопротезирование проксимальных межфаланговых суставов силиконовыми протезами и т.д.)
Состояние костей, суставов и качество мягких тканей
Кости при ревматоидном артрите часто остеопорозны (общий эффект заболевания, нетрудоспособность, кортикостероиды). Обычная фиксация (например, пластина для артродеза кистевого сустава) бывает невозможна из-за плохой фиксации винтов.
Высок риск вовлечения ран в воспалительный процесс. Кортикостероидные препараты также влияют на заживление ран. Метатрексат не ухудшает исход хирургического вмешательства. Блокаторы фактора некроза опухоли усиливают риск хирургической инфекции.
Мягкие ткани часто очень слабые. Сращение может быть поверхностным и неудовлетворительным.
Возможно развитие спонтанного анкилоза суставов. Это может стать преимуществом, например, облегчение сращения кистевого сустава с использованием простого интрамедуллярного стержня.
Мультидисциплинарная практика
Принятие решения об операции проводится всеми участниками и заинтересованными лицами (пациент, семья, опекуны, семейный врач, ревматолог, терапевт кисти).
При ревматоидных заболеваниях возможны и другие тяжелые проблемы костно-мышечной системы. Операция на кисти и запястье могут поставить пациента в зависимость от других (например, невозможность пользоваться костылями после рассечения карпальной связки, невозможность самообслуживания после операции на первом пальце).
Для многих операций необходима специфическое лечение: шинирование, упражнения, манипуляции.
Возможна коррекция медикаментозной терапии до операции. Ингибиторы фактора некроза опухоли перед операцией временно отменяют. За неделю до операции дозу кортикостероидов снижают до минимально допустимого уровня. Применение метотрексата не вызывает проблем.
Ревматоидные узелки
Подкожные узелки. Выявляются на боковых поверхностях проксимальных и дистальных межфаланговых суставов, по локтевому краю проксимальной части предплечья и в области локтевого отростка. Связаны с приемом метатрексата и положительным ревматоидным фактором. При жалобах возможно иссечение, однако вероятно плохое заживление ран, рецидивы и риск повреждения пальцевых нервов.
