Синовиальной оболочки сустава: что это такое, функция
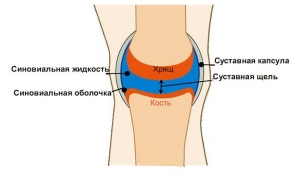
Синовиальная оболочка — дериват специфической дифференцировки скелетогенной мезенхимы.
Внутренний, обращенный непосредственно в полость сустава слой суставной капсулы образует синовиальная оболочка (СО). Ее формирование связано со специфическими дифференцировками, отличными от процессов фибробластогенеза (синовиогенез). Такие дифференцировки происходят одновременно с процессом образования суставной полости, стенками которой и становится СО.
Процесс изучения СО шел путем постепенного вычленения ее из числа мембран, выстилающих полости тела, например серозные полости. Вследствие определенной консервативности научной терминологии, особенно в учебной литературе, клетки СО, непосредственно ограничивающие полость сустава, именуются эпителием (мезотелием) или эндотелием сустава.
По характеру структур J.A. Key предложил различать ареолярный, адипозный и фиброзный типы СО. Ареолярный тип СО покрывает наиболее подвижные участки суставной сумки. Адипозный тип СО выявляется в местах скопления жировых клеток. Фиброзный тип СО обнаруживается в местах сращения капсулы сустава с сухожилиями и связками. Между указанными типами СО имеются переходные (смешанные) формы. На поверхности СО выявляются складки, борозды и ворсинки, которые имеют функциональное значение.
М.А. Барон предложил концепцию, согласно которой ворсинки СО — это реактивные структуры, связанные с движением в суставе. В процессе последующего изучения СО механистическая составляющая этой концепции была отвергнута, но одновременно была выявлена важная функциональная роль синовиальных ворсин, особенно в обеспечении трассудации и резорбции синовиальной жидкости (СЖ).
Наш опыт изучения СО суставов и синовиальных влагалищ с использованием плоскостных (тотальных) препаратов и срезов позволил впервые в 1943, а затем в 1951—1962 гг. предложить общую схему строения СО. Данные, сообщаемые в исследованиях последующих лет, не противоречат этим нашим представлениям.
Покровный слой синовиальной оболочки
Покровный слой СО — это обращенный в полость сустава значительный по толщине соединительнотканный слой. Базальная мембрана, отделяющая покровные клетки от матрикса СО, отсутствует.
Покровный слой СО уникален тем, что здесь соединительная ткань, как дериват мезенхимы, выполняет не свойственную ей пограничную, барьерную функцию, приобретая черты покровной ткани.
Клетки покровного слоя
Покровный слой СО содержит собственно покровные (кроющие) клетки — синовиоциты, а также фибробласты, гистиоциты, макрофаги, плазматические и тучные клетки.
Синовиоциты
Наиболее характерными клетками, определяющими специфические функции СО, являются синовиоциты. Эти клетки обладают большой метаболической активностью. На уровне световой микроскопии синовиоциты обычно описывались как крупные клетки (10,5 х 18,0 мкм) с цитоплазматическими отростками, овальным ядром и мелкозернистой цитоплазмой. Цитоплазматические отростки покровных клеток на поверхности СО переплетаются, но не анастомозируют друг с другом. Эти особенности наиболее отчетливо выявляются на плоскостных (тотальных) препаратах. Гистохимические методики позволили описать в цитоплазме синовиоцитов гранулярную пиронинофильную субстанцию, идентифицируемую как рибонуклеопротеиды, и метахроматический материал, идентифицируемый как гиалуронан.
Покровные клетки СО — это гетерогенная клеточная популяция. Четко отдифференцировать два типа покровных клеток — синовиоцитов на уровне СМ не удавалось. Идентификация стала возможной только при использовании методов ТЭМ. Покровные синовиальные клетки СО принято делить на два типа — синовиоциты А и синовиоциты В. В настоящее время ультраструктурные особенности А- и В-синовиоцитов подробно описаны.
Синовиоциты А представляют собой зрелые макрофаги с высокой фагоцитарной активностью и другими функциями, связанными с регуляцией гуморального и клеточного иммунного ответа. На ультраструктурном уровне синовиоциты А выявляются как крупные клетки с развитыми филоподиями, округлым ядром, в цитоплазме которых присутствуют вакуоли и слабо развитая ГЭС. В цитоплазме синовиоцитов А в норме можно обнаружить фрагменты клеток и матрикса основного вещества СО. Все это подтверждает, что А-клетки непосредственно участвуют в поглощении и лизисе как клеток, так и матрикса.
Синовиоциты В — типичные секреторные клетки, которые продуцируют белки, гликопротеины и гиалуронан. Эти клетки способны к пиноцитозу. Для синовиоцитов В характерны веретенообразная форма, округлое или овальное ядро, немногочисленные отростки цитоплазмы, вакуоли и сильно развитая ГЭС. Синовиоциты В рассматриваются как своеобразная разновидность фибробластов с выраженной способностью к синтезу гиалуронана.
W. Wassilev провел изучение синовиоцитов у взрослых организмов и в процессе онтогенеза. Он предложил характеризовать синовиоциты А (А-клетки) как макрофагоподобные синовиоциты, а синовиоциты В (В-клетки) — как синовиальные фибробласты. Наряду с А- и В-клетками W. Wassilev описал третью форму синовиоцитов — С-клетки как переходные клеточные формы между А и В клетками, а также как клетки —предшественники А- и В-синовиоцитов. В процессе дальнейшего изучения существование синовиоцитов С не было подтверждено.
Полагают, что А-клетки принадлежат к моноцитарной линии клеточной дифференцировки, которые на ранних стадиях развития сустава в составе клеток перихондральной мезенхимы (возможно, и непосредственно из тока крови) проникают в его формирующуюся полость и дифференцируются in situ в макрофагальные А-синовиоциты. В-синовиоциты также являются производными мезенхимальных клеток перихондральной мезенхимы.
Использование иммуноцитохимических методов исследования позволило дифференцировать типы покровных клеток СО и на светооптическом уровне. Также было показано, что, в противоположность всем другим фибробластам, фибробластоподобные синовиоциты типа В ассоциируются с неизвестным эпитопом. В норме в СО среди клеток покровного слоя преобладают фибробластоподобные кроющие клетки типа В (около 90%).
Важно отметить, что никем из исследователей не отмечалась способность покровных клеток СО у взрослых людей и животных к митотическому делению. Оно характерно лишь для клеток СО плодов и новорожденных, а также в условиях патологии (например, при асептическом артрите).
Согласно последним данным, помимо клеток А и В в покровном слое синовии существует небольшая субпопуляция синовиоцитов, имеющих прямое отношение к присутствию в синовии антигенов. Эти клетки продуцируют большое количество антигенов HZARD (1α) подобно антигенпредставляющим дендритным клеткам соединительной ткани, находящимся в Т-клеточнозависимых отделах селезенки, лимфатических узлов и вил очковой железы. Такие клетки имеются также в субсиновиальном слое СО и могут взаимодействовать с Т-лимфоцитами. Содержание лимфоцитов в нормальной СО незначительно.
Биосинтетическая функция клеток покровного слоя
Наличие биосинтетической функции у клеток СО вряд ли требует новых доказательств. Известно, что внеклеточный матрикс во всех разновидностях соединительной ткани является продуктом синтетической активности соединительнотканных клеток. Внеклеточный матрикс СО имеет такое же происхождение.
Очевидно также, что в синовии содержится ряд компонентов, которые либо вообще отсутствуют в циркулирующей крови, либо находятся в ней в значительно меньших концентрациях и, следовательно, синтезируются локально. Ведущую роль в биосинтетических процессах играют синовиоциты В (В-клетки).
Главная функция В-синовиоцитов — синтез больших количеств гликозаминогликана гиалуронана, секретируемого в синовию. Именно гиалуронан является основным фактором, определяющим физические (реологические) свойства синовии, и его концентрация в синовии значительно выше, чем в любой другой биологической жидкости или ткани.
Важно отметить, что в нормальных условиях действуют очень динамичные механизмы регуляции синтеза и секреции гиалуронана в синовию, реагирующие, в частности, на изменения степени гидратации синовии. Внутриклеточные механизмы синтеза гиалуронана в синовиоцитах, очевидно, не отличаются от достаточно хорошо изученных механизмов этого синтеза в других соединительнотканных клетках организма.
Синовиоциты-В, или синовиальные фибробласты, продуцируют ферменты, необходимые для протекающих в СО, синовии и частично в суставных хрящах метаболических процессов. Установлена экспрессия синовиоцитами металлопротеаз из группы ADAMTS-ферментов. Эти металлопротеазы ответственны за катаболизм главного протеогликана суставных хрящей — агрекана. Показано, что в хрящевую ткань фермент попадает из СЖ. К катаболизму коллагенов суставных хрящей имеет отношение экспрессируемый В клетками — катепсин К.
Наряду с компонентами синовии синовиальные фибробласты (В-клетки), как и все другие клетки фибробластического ряда, продуцируют компоненты собственного межклеточного матрикса СО.
Участие клеток покровного слоя в катаболических процессах и резорбции
СО способна очищать СЖ от вводимых в последнюю чужеродных веществ. Наличие этой функции было установлено в многочисленных экспериментах с введением ферритина, декстрана, коллоидного железа, торотраста в полость сустава. Процесс очищения осуществляется путем фагоцитоза чужеродных частиц А-клетка-ми — макрофагальными синовиоцитами.
Фагоцитированные вещества подвергаются в этих клетках катаболизму в лизосомах, содержащих гидролитические ферменты. Согласно гистохимическим данным, эти ферменты локализованы преимущественно в А-клетках СО. К катаболическим реакциям, уравновешивающим постоянно протекающие процессы диффузии из сыворотки крови и собственного биосинтеза в СО причастны и другие ферменты, найденные в ее клетках: глюкозо-6-фосфатдегид-рогеназа, лактатдегидрогеназа, ряд дегидрогеназ цикла Кребса и др.
Матриксные структуры покровного слоя
Продуктом биосинтетической и секреторной деятельности синовиоцитов является не только синовия: синовиоциты продуцируют также компоненты, составляющие матриксные структуры СО.
В коллагеновом каркасе СО преобладают коллагены двух типов — I и III. Эти же коллагены синтезируют синовиоциты В в культурах in vitro. В культурах из нормальной СО на долю коллагена 1типа приходится от 69 до 83% общего количества синтезируемых коллагенов, на долю коллагена III типа — от 19% и более, иногда до 50%, что намного превышает содержание этого коллагена в других разновидностях соединительной ткани взрослых организмов.
Коллаген III типа составляет основу тонких фибрилл, известных под названием ретикулярных. Эти волокна образуют трехмерную сеть. Особенностью их является выраженная аргирофилия, которая обусловлена присутствием гликопротеинов на поверхности волокон.
Клетки нормальной СО экспрессируют, кроме того, небольшие количества коллагена VI типа, образующего сеть очень тонких (диаметром около 9 нм) микрофибрилл в покровном слое. Его функциональная роль не выяснена. По иммуногистохимическим данным, в покровном слое выявляются также коллагены IV и V типов.
Одна из специфических особенностей коллагенов СО заключается в присутствии в них глюкозилгалактозилпиридинолиновой нередуцируемой поперечной связи — Glc-Gal-PYD. В коллагенах костной и хрящевой ткани и в коллагенах других мягких тканей этой поперечной связи нет. Появление в моче у пациентов с заболеваниями суставов пептидов, содержащих эту связь, может расцениваться как показатель вовлечения СО в патологический процесс.
Самой существенной особенностью межфибриллярного матрикса (основного вещества) СО является присутствие гиалуронана в поверхностном слое, совершенно естественное в связи с прямой связью между СО и СЖ. В нормальной СО человека гиалуронан обнаруживается в основном вокруг синовиоцитов поверхностного слоя; в глубоких слоях его содержится значительно меньше.
Наряду с гиалуронаном СО содержит небольшие количества других гликозаминогликанов — хондроитинсульфатов и кератансульфата. Они входят в состав макромолекул малых протеогликанов: хондроитинсульфаты — в состав бигликана и декорина, кератансульфат — в состав фибромодулина.
Поверхностный слой СО обнаруживает интенсивную иммуногистохимическую реакцию на фибронектины. Роль фибронектинов в жизнедеятельности СО подтверждается фактом их биосинтеза культивизируемыми срезами нормальной СО человека. Синтезируемый в культуре фибронектин (его синтез контролировался по включению меченого радиоактивной серой метионина) не только секретировался в среду, но и включался в состав матрикса. Есть предположение, что в продукции фибронектинов принимают участие синовиоциты как типа А, так и типа В. По-видимому, фибронектины во взаимодействии с волокнистой сетью коллагена III типа и гиалуронаном образуют на границе СО и СЖ специализированный слой, контролирующий обмен между этими двумя средами.
Обязательным компонентом нормальной СО оказался один из тенасцинов — тенасцин-Х. Он выявляется также в «синовиальной псевдомембране», развивающейся при расшатывании суставных протезов, и, вероятно, имеет значение для стабилизации супрамолекулярной структурной организации экстрацеллюлярного матрикса мембран.
В ткани СО с помощью иммуногистохимических методов обнаружены соединения, которые известны как компоненты базальных мембран. Это уже упоминавшийся коллаген IV типа, энтактин (нидоген), ламинин, однако их распределение не дает оснований говорить о наличии базальных мембран как оформленных морфологических образований. Компоненты базальных мембран отчетливо выявляются и вокруг кровеносных сосудов СО, хотя и здесь настоящие сформированные базальные мембраны отсутствуют. Можно лишь предполагать, что биохимическим «компонентам» базальных мембран в СО принадлежит определенная роль в структуре экстрацеллюлярного матрикса.
Продуцентами всех биохимических компонентов матрикса являются клетки покровного слоя. В матриксе покровного слоя из волокнистых подлежащих слоев проникают кровеносные капилляры, формируя не столько морфологическую, сколько его функциональную границу.
Матрикс покровного слоя непосредственно наряду с клетками ограничивает суставную полость. Здесь, пожалуй, не лишне еще раз подчеркнуть, что участки основного вещества матрикса между клетками — это не «микродефекты» в оболочке и не места «выпавших» клеток (как считалось еще сравнительно недавно): это структурная специфика покровов синовиальных полостей, закономерная для них как для производных мезенхимы. Именно этой особенностью объясняется столь огорчавшая ранее исследователей невозможность получить четкие границы покровных клеток СО с помощью классических импрегнационных методик, что хорошо удавалось при изучении серозных оболочек и эндотелия сосудов.
Коллагено-эластические комплексы синовиальной оболочки
Поверхностный коллагено-эластический комплекс. Этот пласт соединительной ткани в СО представлен коллагеновыми петлями, петлями эластических волокон, основным веществом и клетками — фибробластами и макрофагами.
Векториальность волокнистых структур особенно четко выражена в суставах с преобладанием движений одного типа (флексия и экстензия — в коленном, локтевом, межфаланговых суставах). Расположение коллагеновых волокон четко прослеживается и при рассмотрении поверхности СО, особенно в участках, где СО подлежит более твердый субстрат. Регулярная волнистость хорошо выражена. Петли эластической сети вытянуты в направлении расположения коллагеновых волокон. В основном веществе отмечается β-метахромазия. По нашим данным, толщина поверхностного коллагено-эластического комплекса в коленном суставе взрослого человека составляет 245 ± 55 мкм. Фибробласты в составе поверхностного коллагено-эластического комплекса СО обладают характерными для этих клеток соединительной ткани чертами.
Глубокий коллагено-эластический комплекс. Коллагеновые и эластические компоненты этого слоя СО также строго упорядочены и векториальны.
Эластические волокна глубокого коллагено-эластического комплекса более мощные, чем в поверхностном комплексе. Они образуют широкопетлистые сети, наиболее полно выявляющиеся на плоскостных тотальных препаратах при последовательном микроскопировании препарата от поверхности в глубину. На обычных гистологических срезах, произведенных перпендикулярно к поверхности, нельзя получить полного представления о характере этих структур. Основное вещество глубокого слоя СО обладает слабой (3-метахромазией, содержит ретикулярные волоконца. Здесь выявляются фибробласты, единичные макрофаги, а иногда и значительное число тучных клеток. Толщина глубокого коллагено-эластического комплекса СО в коленном суставе человека, по нашим данным, составляет 600±150 мкм.
Микроциркуляторные структуры и процессы в синовиальной оболочке
Кровоснабжение
СО сустава обильно снабжается кровеносными сосудами от ветвей артерий, васкуляризующих данную область. Кровеносные сосуды, приносящие кровь в суставную капсулу и, в частности, в СО, связаны с сосудами, питающими кожу области сустава, и сосудами эпифизов и метафизов сочленяющихся в данном суставе костей.
Установлено, что артериолы сосудов фиброзной оболочки капсулы сустава, проникая в СО, формируют двухмерную сеть — артериолы, прекапилляры и капилляры, посткапилляры, венулы собственно СО и сосуды тех же калибров в субсиновиальной ткани. Венозная часть обоих участков образует общие венулы.
Кровеносные сосуды капсулы сустава являются частью единой кровеносной системы, более крупные стволы которой лежат в фиброзной оболочке и в глубоком коллагено-эластическом слое СО, а артериолы, капилляры, посткаппиляры и венулы — во всех слоях. Капилляры проникают и в покровный слой СО.
Во всех слоях СО сосуды многократно ветвятся. Между параллельно идущими артериолами и венулами располагаются густые капиллярные сети с округлыми или овальными петлями.
Согласно данным, сообщаемым JI.A. Манукян, артериолы фиброзной оболочки капсулы сустава, переходя в СО, разделяются на прекапилляры и капилляры, которые образуют двухмерную сеть. Автор настаивает на разделении артериол общей сети на артериолы собственно СО и артериолы субсиновиальнго слоя (в тех участках суставной капсулы, где он реально существует). В больших по площади участках полости сустава глубокий коллагено-эластический слой СО прилежит непосредственно к фиброзной ткани капсулы, что не дает оснований для выделения особого субсиновиального слоя.
Как указывает Л.А. Манукян, капилляры обоих слоев связаны между собой в непрерывную сеть и имеют общие пути оттока, поскольку посткапилляры синовиальной и субсиновиальной сетей формируют общие венулы. Эти данные исключают присутствие конечных артерий в СО, что подтверждает нашу точку зрения. Существование конечных артриол не исключено только лишь в тех участках СО, где образуются жировые подушки. Здесь действительно одна артериола приносит кровь в сеть капилляров, отток крови от которых идет через одну-единственную венулу. Эти участки кровеносного русла СО целесообразно, по-видимому, считать теми типичными локальными структурными элементами («идеальными модулями») микроциркуляции, на которые указывает В.В. Куприянов и др.
Интересны данные Л.A. Манукян о том, что для СО крупных суставов человека (в частности коленного) характерно отчетливое преобладание посткапилляров и венул над артериолами и прекапиллярами. Эта морфологически подтверждаемая особенность связана с функциональной характеристикой СО как арены весьма интенсивных обменных процессов между сосудистым руслом и суставной полостью. Речь идет не только о кровоснабжении ткани самой СО, но и об участии в обмене между сосудистым руслом и суставной полостью. Структурной особенностью сосудистого русла СО является наличие артериовенозных анастомозов у основания синовиальных ворсин. Такие укороченные пути между артериальным и венозным руслами — одно из важных приспособлений для регуляции кровообращения в капиллярном звене.
Изучением кровоснабжения СО в течение многих лет занимается В.Ш. Вагапова. Ею показано, что СО коленного сустава снабжается кровью артериями мышечного типа, которые являются ветвями артерий капсулы сустава. Располагаются эти артерии между покровным и коллагено-эластическим слоями СО. От ветвей таких артерий отходят прекапиллярные артериолы. Они имеют специфические структуры для регуляции гемодинамики: сифонные устройства и сфинктеры.
Кровеносные капилляры СО образуют различные конструкции: ячеистые сети, капиллярные петли и пучки, сеть для васкуляризации синовиальных ворсин и т.д. Капилляры поверхностной кровеносной сети имеют различный диаметр, но особого внимания заслуживают широкие, диаметром порядка 20 мкм, капилляры. Они залегают рядом с синовиоцитами, и под ними глубокий коллагено-эластический слой СО истончается. Эти структуры напоминают «насасывающие люки» брюшины диафрагмы. В СО они формируются за счет расхождения волокон в глубоком коллагено-эластическом слое, разрежения волокон в поверхностном коллагено-эластическом слое и истончения клеточного поверхностного слоя СО. Последний состоит из одного слоя покровных клеток. Описанные структуры обеспечивают процессы транссиновиального обмена.
При слиянии капилляров формируются посткапиллярные венулы.
В глубокой кровеносной сети обнаруживаются артериоловенулярные анастамозы. Однако такие структуры являются непостоянными. Обычно они выявляются в период роста организма, а также при нарушениях гемодинамики в условиях патологии.
В СО суставов гемосиновиальный барьер представлен тремя компонентами: синовиоцитами, основным веществом, и эндотелием кровеносных капилляров. Морфологическая, биохимическая и функциональная характеристики двух первых компонентов уже освещены в данной главе. Важно отметить, что и основное вещество покровного слоя СО и СЖ имеют общий источник образования — продуцируются синовиоцитами. Можно говорить об отсутствии барьера между синовией и матриксом СО (ведь базальной мембраны между клетками и матриксом оболочки не существует) и тем самым признать барьерные функции только за эндотелиальной стенкой капилляров. В этом утверждении, однако, кроется опасность недооценки основного вещества покровного слоя СО как среды, обеспечивающей регулирование потока веществ, проникающих из полости в сосуды СО и в противоположном направлении. Вряд ли нужно сводить понятие гемосиновиального барьера только к сосудистой стенке.
Третий компонент — сосудистая стенка представлена эндотелиоцитами, субэндотелиальной базальной мембраной, гладко-мышечными клетками и элементами адвентиции. В структуре артериол СО выявляются некоторые особенности. К ним относятся миоэндотелиальные клеточные контакты и значительные пространства основного вещества матрикса СО за пределами адвентиции. Эти участки мы склонны рассматривать как элементы интерстициального (несосудистого) пути циркуляции.
Прекапилляры имеют стандартное строение. Мышечные элементы распределены неравномерно, но всегда присутствуют в местах ветвления. Стенка капилляра (диаметр 6 мкм) сформирована эндотелиоцитами, прерывистой базальной мембраной и перицитами.
Следует особо подчеркнуть развитие экстракапиллярных пространств, заполненных основным веществом. Это места обеспечения контакта капилляров с тканевыми компонентами и среда для перемещения веществ. В стенках посткапилляров сосудистого русла СО не отмечена какая-либо специфика. Венулы отличаются широким просветом, хорошо выявляющейся базальной мембраной, наличием перицитов, мышечных элементов. Паравазальные участки основного вещества матрикса СО хорошо выражены.
Лимфатический дренаж
Детальное исследование лимфатических сосудов СО суставов и синовиальных влагалищ человека и собаки проведено В.Ш. Вагаповой, Л.А. Манукян и С. А. Сисакян. Наши собственные исследования лимфатического русла СО проведены с применением безинъекционного метода импрегнации аммиачным серебром по Гойеру плоскостных (тотальных) препаратов на человеческом и экспериментальном материале.
Глубокая сеть лимфатических сосудов состоит из капилляров и посткапилляров, которые располагаются вдоль артериол и венул. У лимфатических капилляров базальная мембрана отсутствует, а у посткапилляров она имеет прерывистый характер. Лимфатические посткапилляры, в отличие от капилляров, имеют клапаны, которые обеспечивают ток лимфы в одном направлении. Они следуют между покровным и поверхностным слоями СО, а далее впадают в периартикулярные лимфатические сосуды.
Нами изучены соотношения компонентов кровеносного и лимфатического русел СО с применением планиметрических методик на тотальных плоскостных препаратах. Эти данные свидетельствуют, что суммарная площадь лимфатического русла относится к суммарной площади кровеносного как 1,9: 1. Лимфатическое русло СО выполняет дренажную функцию, осуществляя всасывание высокомолекулярных метаболитов, не поступающих в венозный отдел микроциркуляторной системы.
Клеточные контакты между эндотелиоцитами непостоянны и изменяются в зависимости от функционального состояния, в частности, при возрастании потребности во всасывании веществ из окружающей лимфатический капилляр среды. Плотность прилегания эндотелиоцитов друг к другу при этом уменьшается, и внутрикапиллярное лимфатическое пространство получает возможность непосредственного контакта со средой, окружающей капилляр.
Имеются экспериментальные данные, которые подтверждают существование в основном веществе матрикса не выстланных клетками перилимфатических пространств, образующих своеобразную систему перемещения метаболитов.
Интерстициальные пути микроциркуляции
Представления о процессах микроциркуляции в организме основано на изучении трех облигатных структурных компонентов: это кровеносные капилляры, лимфатические капилляры и интерстициальные (внесосудистые, внутритканевые) пути циркуляции. В любом участке организма и, естественно, в СО суставов они образуют рабочие функциональные единицы, обозначаемые различными авторами как модули блока, микрорайоны. Из трех компонентов этих функциональных единиц микроциркуляции наименее изучены интерстициальные пути, в первую очередь их пространственная организация.
Пространственная организация волокнистых компонентов матрикса СО — рыхлое расположение звеньев волокнистого каркаса, отсутствие четко выраженной преимущественной ориентации коллагенных фибрилл и волокон — затрудняет выявление закономерностей топографии микроциркуляционных путей. Наиболее надежными ориентирами являются, по-видимому, закономерности расположения сосудистых капиллярных русел (кровеносных капилляров в первую очередь), которые, как известно, находятся во всех слоях СО, включая ее покровный слой.
Наши данные свидетельствуют в пользу того, что паравазальные пространства должны быть признаны реально существующими. По-видимому, для богато васкуляризованных тканей, к которым принадлежит СО, именно эти участки матрикса являются непосредственными путями интерстициального движения метаболитов.
Функциональные возможности паравазальных пространств в СО обеспечиваются взаимодействием параплазмолеммального слоя и базальной мембраны капилляра и основного вещества капиллярного ложа. Изучение этих закономерностей имеет принципиальное значение для понимания изменений проницаемости СО в условиях патологии.
Нами прослежены возможные пути транссиновиального обмена. Показаны пути перемещения веществ в пределах СО, а также связи содержимого суставной полости с кровеносным и лимфатическим руслами организма. При этом сама СО характеризуется как сложная диффузионная мембрана.
Вместе с тем именно в СО количественные показатели транссиновиального обмена значительно отличаются от тех, которые можно было бы ожидать, учитывая величину молекулярной массы перемещаемых веществ.
Изучение кинетики диффузионных процессов в СО показало, что скорость транссиновиального движения глюкозы выше той, что соответствует размерам ее молекулы. Скорость транссиновиального перемещения белков, преимущественно альбуминов, почти в 100 раз ниже соответствующего коэффициента для воды; в то же время скорость транссиновиального обмена выше для веществ, обладающих липофильностью.
Приведенные выше данные позволяют считать, что перемещение молекул в СО идет против градиентов концентрации веществ, а следовательно, должно регулироваться механизмами, обладающими избирательностью и немалым энергетическим потенциалом. Реализация этих механизмов возможна только на уровне клеточных элементов — синовиоцитов СО и эндотелиоцитов кровеносных капилляров. Эти механизмы постоянно работают в норме и первыми изменяются в условиях воспаления и дистрофии.
Обменные процессы между суставной полостью и сосудистыми руслами организма
Существование синовиальной среды сустава как единой функциональной системы невозможно без обеспечения ее гомеостатических параметров. Основным субстратом этих процессов является СО и в первую очередь клетки, матрикс и сосуды ее покровного слоя.
Проникновение веществ из крови в суставную полость
По мнению большинства исследователей, инородные вещества в кристаллоидном и коллоидном состоянии, появившиеся в крови, а также вещества, свойственные крови, по той или иной причине содержащиеся в ней в больших, чем в норме, концентрациях, всегда проникают в суставную полость. Скорость проникновения для кристаллоидов выше, чем для коллоидов. Проникновение коллоидов при прочих равных условиях находится в прямой зависимости от степени от их дисперсности, а именно проникновение тем слабее, чем крупнее частицы проникающего вещества.
Относительно проницаемости патологически измененной СО для веществ, находящихся в крови, все исследователи единодушны в том, что воспалительные процессы повышают ее проницаемость в направлении кровь—сустав. Известно, что микроорганизмы поступают из крови в СЖ гораздо быстрее, чем в водянистую влагу глаза или спинномозговую жидкость. Именно этим объясняют частые вовлечения суставов в патологический процесс при инфекционных заболеваниях.
Проникновение веществ из суставной полости в направлении сустав—сосудистые русла организма
Согласно современным представлениям, существуют определенные закономерности поступления веществ из суставных полостей в кровеносные сосуды. Основными из них являются следующие:
- Кристаллоидные и коллоидные растворы, всасываются СО и проникают в кровеносные сосуды по основному веществу, не имея на своем пути каких-либо преформированных путей: канальцев или щелей.
- Кристаллоидные растворы, очень быстро поступают в циркуляторное кровяное русло. Коллоидные растворы всасываются значительно медленнее. Определяющим при всасывании коллоидов является величина молекулы коллоида.
- Протеины, грубодисперсные коллоидные растворы, взвеси и клетки не способны в норме проникать из сустава в кровеносные сосуды. Их удаление из сустава связано с лимфатическими путями.
Для понимания закономерностей лимфатического дренажа суставов большую роль сыграли работы Д.А. Жданова и сотрудников, убедительно показавших значение межклеточного матрикса— межуточной субстанции соединительной ткани, в пределах которой происходят процессы всасывания.
В свое время повторив опыты с введением в сустав животного окрашенных взвесей (тушь, берлинская лазурь, кармин), мы получили морфологические картины, близкие к данным цитированных работ. Вместе с тем у нас сложилась полная уверенность в непригодности подобных методических подходов для решения вопроса о закономерностях проникновения веществ из неповрежденного сустава в лимфатическое русло.
Опыты, о которых идет речь, показали, что корпускулярные частицы в условиях повышенного давления в суставе, вызванного введением жидкости, действительно могут проникать в ткань СО, а затем попадать в лимфатические сосуды (это подтверждается обнаружением частиц взвеси в региональных лимфатических узлах). Данные опыты выявили также то, что такие воздействия, как прокол СО, введение даже стерильной и изотонической жидкости с чужеродными частицами приводит к последующей коагуляции взвеси, повышению внутрисуставного давления, нарушению баланса электролитов, повреждению тканей СО.
Участие клеток синовиальной оболочки в процессах обмена между суставной полостью и сосудами
Наши наблюдения подтверждают точку зрения о значительных фагоцитарных возможностях покровных клеток СО, что особенно проявляется в условиях асептического воспаления в суставе. Фагоцитоз форменных элементов крови покровными клетками СО, наблюдаемый нами в условиях экспериментального гемартроза, безусловно способствует удалению клеток из полости сустава и поступлению в дренажные системы СО. Однако нельзя говорить о том, что поглощение веществ покровными клетками и макрофагами является основным способом удаления их из полости сустава. Главная роль в этом процессе остается за лимфатическим дренажем полости сустава.
Топография и морфофункциональиые особенности отдельных зон синовиальной оболочки на примере коленного сустава
Эксперименты по изучению резорбции и транссудации веществ в суставной полости, проведенные нами на коленных суставах животных (кошек, собак, кроликов), показали возможность различать в суставной полости три основные функционально неоднозначные зоны.
Иннервация сустава
Распределение нервных волокон между структурами сустава неравномерно: обильно васкуляризованные структуры СО являются также и хорошо иннервированными, в то время как в структурах, бедных сосудами, нервных волокон меньше.
Афферентная иннервация. Рецепторные аппараты сустава представлены свободными и инкапсулированными нервными окончаниями.
Свободные (неинкапсулированные) чувствительные нервные окончания обнаружены как в фиброзной оболочке, так и в СО капсулы сустава.
Несвободные (инкапсулированные) чувствительные нервные окончания капсулы сустава представляют собой концевые веточки ветвления дендрита нервных клеток, заключенные внутри капсулы нервного окончания, образованной изнутри лемоцитами, а снаружи соединительной тканью. Они обнаруживаются в глубоком коллагено-эластическом слое СО. Часть их находится в адвентиции кровеносных сосудов.
Симпатическая иннервация. Проникая в сосудистую стенку, эти волокна оканчиваются на гладкомышечных клетках средней оболочки сосуда, формируя типичные для гладкой мышечной ткани эффекторные нервные окончания.
Нервные волокна идут к синовиальной ворсине вместе с кровеносными сосудами и образуют главным образом свободные нервные окончания в виде петель, кустиков и клубочков. В молодую синовиальную ворсину нервные волокна врастают, как ветви от более крупного ствола, а затем они формируют неинкапсулированные нервные окончания. В инволюционирующей синовиальной ворсине нервные элементы дегенерируют с распадом осевого цилиндра.
Существующие представления об иннервации суставов в норме приведены в обзорной работе P.S. Марр, который предлагает делить нервные структуры, иннервирующие сустав, на первичные и добавочные. К первичным нервным структурам P.S. Марр относит ветви периферических смешанных нервов, которые иннервируют область суставов, к добавочным нервным структурам — ветви внутримышечных нервов, которые проникают в капсулу сустава и иннервируют ее. Ряд суставов, к которым относится и коленный, получают также иннервацию от ветвей кожных нервов области данного сустава.
В структурах сустава выявляются нервные окончания различного диаметра. По этому признаку P.S. Марр делит все нервные окончания на четыре класса. К первому классу относятся нервные окончания с диаметром 10—18 мкм, ко второму — 5—12мкм, к третьему — 1—5 мкм, к четвертому — окончания с диаметом менее 1мкм. Нервные окончания первых трех классов являются миэлизированными, а окончания четвертого класса — немиэлизированными.
В связках сустава выявляются нервные окончания первого класса. Они обеспечивают проприоцептивную чувствительность. Нервные окончания, относящиеся ко второму классу, характерны для суставной сумки. Нервные окончания третьего и четвертого классов выявляются как в суставной сумке, так и в СО.
В структурах нервной ткани суставов выявлен ряд нейропептидов, которые играют существенную роль в обеспечении нормального функционирования сустава, а в условиях патологии участвуют в формировании патологического процесса.
Особый интерес представляют два нейропептида: нейропеп-тид SP (субстанция Р) и кальционин генсвязанный нейропептид (CGRP). Нейропептид SP обладает провоспалительным действием. Доказано, что у больных с РА он участвует в патогенезе заболевания. Нейропептид CGRP обладает противовоспалительным действием, и его содержание в нервных фибриллах у больных с РА понижено.
Нейропептид SP хорошо изучен. Он широко распространен в центральной и периферической нервной системах и представляет собой небольшой полипептид из 11-ти аминокислот, который был выделен и синтезирован.
Показано, что выделение гистамина тучными клетками регулируется не только иммунными механизмами, но и нейропептидами.
Это обстоятельство представляет интерес, поскольку оно является основой для возникновения воспаления в суставе под действием нейропептидов. Последнее подтверждает участие нервных структур в патогенезе заболеваний суставов.
