Гормоны мозгового вещества надпочечников, катехоламины
Биосинтез и секреция
Катехоламины содержат катехоловое ядро (бензольное кольцо с двумя гидроксильными боковыми группами) и боковую цепь с аминогруппой. К катехоламинам относятся дофамин, норадреналин и адреналин.
Катехоламины широко распространены в растительных и животных организмах. У млекопитающих адреналин синтезируется преимущественно в мозговом веществе надпочечников, а норадреналин — не только в надпочечниках, но и в ЦНС и периферических симпатических нервах. Дофамин (предшественник норадреналина) обнаруживается как в мозговом веществе надпочечников, так и в адренергических нейронах. В высоких концентрациях он присутствует в головном мозге, в специализированных нейронах симпатических ганглиев и в сонном гломусе, где играет роль нейротрансмиттера. Дофамин содержится также в специализированных тучных клетках и энтерохромаффинных клетках.
Пептид ХгА запасается и выделяется путем экзоцитоза вместе с катехоламинами; фрагмент его предшественника, катестатин, ингибирует дальнейшую секрецию катехоламинов, являясь антагонистом холинергических рецепторов нейрона. У больных с гипертонической болезнью уровень ХгА в сыворотке несколько повышен, но интересно, что у детей таких больных он снижен. У тех людей белой расы, у которых снижен уровень катестатина, усилена прессорная реакция на катехоламины. Таким образом, относительный дефицит катестатина может увеличивать риск последующего развития гипертонической болезни. Соотношение адреналина и норадреналина в мозговом веществе надпочечников у разных видов различно. У человека на долю норадреналина в этом веществе приходится 15-20% общего количества катехоламинов.
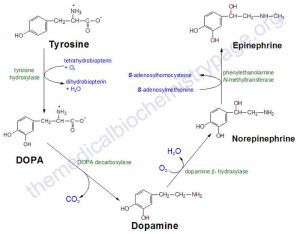
А. Превращение тирозина в ДОФА
Катехоламины синтезируются из тирозина, который поступает с пищей или образуется в печени из фенилаланина. Концентрация тирозина в крови составляет 1-1,5 мг%. Он проникает в нейроны и хромаффинные клетки с помощью механизма активного транспорта и превращается в этих клетках в L-дигидроксифенилаланин (L-ДОФА). Реакция катализируется тирозингидроксилазой, которая с аксональным током перемещается в нервные окончания. Тирозингидроксилаза ограничивает скорость всего процесса синтеза катехоламинов. Транскрипция этого фермента активируется ацетилхолином, действующим через никотиновые холинергические рецепторы, которые в свою очередь (через цАМФ) активируют протеинкиназу А. Многие вещества снижают активность тирозингидроксилазы. Мощным ее ингибитором является α-метилтирозин (метирозин), который иногда используют в лечении злокачественных феохромоцитом.
Б. Превращение ДОФА в дофамин
ДОФА превращается в дофамин под влиянием декарбоксилазы ароматических аминокислот (ДОФА-декарбоксилазы). Этот фермент присутствует во всех тканях, но в особенно высоких концентрациях — в печени, почках, головном мозге и семявыносящих протоках. В разных тканях фермент обладает разной субстратной специфичностью. Конкурентные ингибиторы ДОФА-декарбоксилазы
(такие, как метилдофа) превращаются в соединения (например, в осметилнорадреналин), которые запасаются в гранулах нейронов и секретируются вместо норадреналина. Считалось, что эти соединения (ложные трансмиттеры) опосредуют гипотензивный эффект лекарственных веществ, действующих на уровне периферических симпатических синапсов, но в настоящее время полагают, что они активируют ос-рецепторы ингибиторных кортикобульбарных нейронов, снижая тем самым стимуляцию симпатических нервов.
В. Превращение дофамина в норадреналин
Дофамин поступает в гранулы клеток, где под действием дофамин-β-гидроксилазы (ДБГ), локализованной в мембранах гранул, гидроксилируется, превращаясь в норадреналин, который и хранится в этих гранулах. Гранулы перемещаются к клеточной поверхности и секретируют свое содержимое путем экзоцитоза. При этом из клеток выходит не только норадреналин, но и ДБГ. Выделившийся норадреналин жадно поглощается тем же нервом (обратный захват), но часть его диффундирует из синаптической щели в кровь. В норме уровень норадреналина в крови в основном определяется его диффузией из вненадпочечииковых синапсов симпатических нервов.
Г. Превращение норадреналина в адреналин
Норадреналин может диффундировать из гранул в цитоплазму. В некоторых клетках (особенно в мозговом веществе надпочечников) цитоплазматический фермент ФЭМТ катализирует его превращение в адреналин, который либо возвращается в секреторные гранулы, либо диффундирует из клетки, либо разрушается. Высокие концентрации кортизола усиливают экспрессию гена, кодирующего ФЭМТ. В таких высоких концентрациях кортизол присутствует в большинстве участков мозгового вещества надпочечников, поступая туда из коркового вещества с венозной кровью. Именно поэтому в мозговом веществе надпочечников человека на долю адреналина приходится около 80% всех катехоламинов, а на долю норадреналина — лишь 20%. Параганглиомы редко секретируют адреналин, поскольку местная концентрация кортизола в них недостаточна для активации синтеза ФЭМТ. Феохромоцитомы секретируют адреналин и норадреналин в различных соотношениях. Интересно, что при рецидивах феохромоцитомы секреция адреналина происходит в отсутствие коркового вещества, окружающего опухоль. Это свидетельствует о сохранении повышенной активности гена ФЭМТ в дочерних клетках феохромоцитомы. Удаление обоих нормальных надпочечников приводит к резкому падению уровня адреналина в крови, тогда как содержание норадреналина не снижается, поскольку его главным источником являются синапсы симпатических нервов.
ФЭМТ содержится во многих тканях, в том числе в легких, почках, поджелудочной железе и раковых клетках. Поэтому вненадпочечниковые ткани способны превращать норадреналин в адреналин. Однако уровень адреналина в крови лишь в минимальной степени зависит от его продукции этими тканями. Глюкокортикоиды увеличивают содержание ФЭМТ в легких человека, что может определять бронхорасширяющее действие этих соединений (при ингаляционном или системном введении). ФЭМТ присутствует также в эритроцитах, где ее активность возрастает при гипертиреозе и снижается при гипотиреозе. Активность ФЭМТ в почках
настолько высока, что почти половина адреналина, определяемого в моче, может быть следствием его образования из норадреналина именно в этих органах.
Секреция катехоламинов сопряжена с их биосинтезом. Поэтому запасы норадреналина в нервных окончаниях, даже при резком повышении симпатической активности, практически не меняются. Однако длительная гипогликемия может приводить к истощению запасов катехоламинов в мозговом веществе надпочечников. Биосинтез норадреналина при стимуляции симпатических нервов усиливается, по-видимому, за счет активации тирозингидроксилазы. При длительной стимуляции возрастает и количество этого фермента.
Запасание
Содержание катехоламинов в органах отражает плотность их симпатической иннервации и составляет в мозговом веществе надпочечников около 1,5 мг/г, в селезенке, семявыносящих протоках, головном и спинном мозге и сердце — 1-5 мг/г, а в печени, кишечнике и скелетных мышцах — 0,1-0,5 мг/г. Катехоламины запасаются в электрон-ноплотных гранулах диаметром около 1 мкм, в которых присутствуют также АТФ (в молярном отношении 4:1), некоторые нейропептиды, кальций, магний и водорастворимые белки, называемые хромогранинами (см. ниже). Во внутренней мембране гранул локализованы ДБГ и АТФаза. Mg2+-зависимая АТФаза облегчает захват катехоламинов гранулами и тормозит их выделение из гранул. Гранулы хромаффинных клеток надпочечников содержат и выделяют целый ряд активных пептидов, включая адреномедуллин, АКТГ, ВИП, хромогранины и энкефалины. Образующиеся из хромогранинов пептиды обладают физиологической активностью и могут модулировать секрецию катехоламинов.
Секреция
Секреция катехоламинов мозговым веществом надпочечников возрастает при физической нагрузке, стенокардии, инфаркте миокарда, кровотечениях, эфирном наркозе, хирургических операциях, гипогликемии, аноксии и асфиксии и во многих других стрессорных ситуациях. В ответ на гипогликемию и большинство других стимулов секреция адреналина увеличивается в большей степени, чем секреция норадреналина. Однако при аноксии и асфиксии надпочечники секретируют больше норадреналина, чем при других стимулах.
Секреция гормонов мозгового вещества надпочечников стимулируется ацетилхолином, который выделяется окончаниями преганглионарных симпатических волокон. Возникающая деполяризация мембраны клеток сопровождается притоком ионов кальция. Повышенная внутриклеточная концентрация этих ионов стимулирует экзоцитоз секреторных гранул, содержащих катехоламины, хромогранины и растворимую ДБГ. Связанная с мембраной гранул ДБГ при экзоцитозе не выделяется.
Транспорт
В крови катехоламины взаимодействуют с альбумином или аналогичным белком, обладающим низким сродством и высокой емкостью для этих гормонов.
Метаболизм и инактивация катехоламинов
Катехоламины быстро превращаются в неактивные вещества — метанефрины, ВМК и конъюгированные соединения.
Избыток норадреналина в клетках инактивируется преимущественно путем дезаминирования; эта реакция катализируется моноаминоксидазой (МАО), локализованной на наружной мембране митохондрий. (МАО регулирует содержание катехоламинов в нейронах; прогестерон повышает, а эстрогены снижают уровень этого фермента). Образующийся альдегид окисляется в 3,4-диги-дроксиминдальную кислоту (ДГМК) или дигидроксифенилгликоль (ДГФГ). Последний под
действием катехол-О-метилтрансферазы (КОМТ) превращается в ВМК, которая выводится с мочой. В ткани феохромоцитомы связанная с мембраной КОМТ превращает адреналин в метанефрин, а норадреналин — в норметанефрин. Эти метаболиты секретируются в кровь. Поэтому у больных с феохромоцитомами основным источником норметанефрина крови (около 93%) является ткань опухоли, а не периферический метаболизм катехоламинов.
Катехоламины, выделяющиеся в синапсы, взаимодействуют со своими рецепторами с относительно низким сродством и быстро отсоединяются от них. Примерно 15% норадреналина диффундирует из синапса в кровь, а остальное его количество поступает обратно в нерв или в клетку-мишень, после чего он может вновь запасаться в гранулах или инактивироваться, как описано выше. Захват катехоламинов является насыщаемым, энерго- и Nа+-зависимым и стереоспецифическим процессом. Трициклические антидепрессанты, фенотиазины, производные амфетамина и кокаин блокируют захват катехоламинов из синаптической щели.
Норадреналин крови под действием КОМТ превращается в норметанефрин; донором метальной группы для этой реакции служит S-аденозил-метионин. КОМТ присутствует во многих тканях, особенно в клетках крови, печени, почках и гладкомышечной оболочке сосудов. Адреналин аналогичным образом превращается метанефрин, часть которого затем превращается в ВМК. Инактивация катехоламинов происходит и путем конъюгирования их фенольных гидроксильных групп с сульфатом или глюкуронидом. Эти реакции протекают главным образом в печени, кишечнике и эритроцитах.
Катехоламины и их метаболиты выводятся из организма с мочой. В норме в моче примерно 50% этих соединений представлено метанефринами, 35% — ВМК, 10% — конъюгированными катехола-минами и другими метаболитами; на долю свободных катехоламинов приходится менее 5%.
Катехоламиновые (адренергические) рецепторы
Согласно современной классификации адрено-рецепторов, тип альфа подразделяется на α1А, α1В, α1С, α2А, α2B α2С, а тип бета — на β1, β2, β3 и β4. Эти рецепторы по-разному распределены в ЦНС и периферических тканях.
Классификация адренорецепторов исходно базируется на сравнительной силе эффектов их различных агонистов и антагонистов. В целом α-рецепторы сильнее активируются норадреналином, чем адреналином, тогда как β-рецепторы, наоборот, сильнее активируются адреналином.
Адренорецепторы представляют собой трансмембранные белки с N-концевым внеклеточным и С-концевым внутриклеточным доменами. Все адренорецепторы содержат по семь трансмембранных гидрофобных участков. Аминокислотные последовательности этих участков в разных рецепторах высокогомологичны; специфичность связывания агонистов определяется различиями в строении лишь пятого и шестого трансмембранных доменов. От различий пятого и седьмого доменов зависит сопряжение рецепторов с разными G-белками (связывающими гуаниловые нуклеотиды). G-белки состоят из α-, β- и γ-субъединиц, строение которых в разных G-белках различается. При связывании гормона с рецептором β- и γ-субъединицы G-белка диссоциируют, а ГДФ на α-субъединице заменяется на ГТФ. Связанная с ГТФ ос-субъединица активирует пострецепторные пути проведения гормонального сигнала.
А. Альфа-адренорецепторы
Альфа,-рецепторы расположены на постсинаптической мембране клеток органов-мишеней и, как правило, опосредуют вазоконстрикцию, сокращение других гладких мышц и расширение зрачка. Норадреналин обладает несколько большим сродством к этим рецепторам, чем адреналин. При связывании агониста с α1-рецепторами от Gq-белка отсоединяется альфа-субъединица, которая активирует фосфолипазу С. Этот фермент катализирует превращение фосфатидилинозитол-4,5-дифосфата в инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерин (ДАГ). ИФ3 стимулирует высвобождение кальция из внутриклеточных депо, вызывая физиологические реакции клеток. ДАГ активирует протеинкиназу С, которая фосфорилирует ряд белков, инициирующих или поддерживающих эффекты ИФ3 и ионов кальция. Селективными антагонистами α1-рецепторов являются празозин и феноксибензамин.
{module директ4}
Альфа2-рецепторы локализованы на пресинаптической мембране окончаний симпатических нервов. Норадреналин и адреналин взаимодействуют с этими рецепторами, что по механизму отрицательной обратной связи тормозит выделение нейротрансмиттера из нервных окончаний. Альфа2-рецепторы присутствуют также на тромбоцитах и на постсинаптической мембране адипоцитов, гладких мышц и клеток ЦНС.
В головном мозге α2-рецепторы обнаружены в голубом пятне (locus ceruleus), коре больших полушарий и лимбической системе. Стимуляция α2-рецепторов постсинаптических мембран также тормозит выделение норадреналина. Агонистом центральных α2-рецепторов является клонидин.
Связывание агонистов с α2-рецепторами приводит к отделению альфа-субъединицы от Gi-белка. Эта субъединица ингибирует аденилатциклазу и снижает продукцию цАМФ. Селективным антагонистом α2-рецепторов является йохимбин, тогда как фентоламин блокирует как а1-, так и α2-рецепторы.
Б. Бета-адренорецепторы
Бета-адренорецепторы представляют собой гликопротеины, расположенные на постсинап-тической мембране клеток органов-мишеней. Связывание β-рецепторов с агонистами приводит
к отсоединению альфа-субъединицы от Gs-белка, которая активирует аденилатциклазу и увеличивает образование цАМФ. Последний активирует протеинкиназу А, фосфорилирующую различные белки, включая ферменты, ионные каналы и рецепторы. Различают три основных подтипа р-адренорецепторов.
Бета-адренорецепторы локализованы в основном в сердце и почках и активируются норадреналином, адреналином и дофамином, приводя к увеличению частоты сердечных сокращений и минутного объема сердца, а также секреции ренина юкстагломерулярным аппаратом почек и повышению артериального давления (через ренин-ангиотензиновую систему). Трийодтиронин (Т3) увеличивает число β-рецепторов в сердце, что может усиливать сердечные сокращения и способствовать возникновению тахиаритмий.
Бета2-адренорецепторы присутствуют в бронхах, матке, печени и скелетных мышцах, а также в артериолах сердца, легких и скелетных мышц. Активация β2-рецепторов приводит к усилению гликогенолиза, расширению бронхов, вазодилатации и расслаблению матки (вероятно, за счет фосфорилирования легких цепей миозина). Адреналин активирует β2-адренорецепторы гораздо сильнее, чем норадреналин. Различия в чувствительности больных бронхиальной астмой к сальбутамолу и женщин с ожирением к адреналину связаны с полиморфизмом этих рецепторов.
Бета3-адренорецепторы экспрессируются в жировой ткани, желчном пузыре, толстой кишке, ЦНС и сердце. Активация этих рецепторов увеличивает энергозатраты и усиливает липолиз и перистальтику кишечника. У индейцев племени Пима гомозиготная мутация гена β3-рецепторов ассоциируется с ранним началом сахарного диабета 2-го типа. У гомо-и гетерозигот с полиморфизмом гена β3-рецептора Трп (64)-Арг снижена активность симпатической нервной системы в покое. Активация β3-рецепторов в сердце снижает сократимость желудочков за счет увеличения образования оксида азота.
Бета4-адренорецепторы («мнимые» β-рецепторы) кодируются тем же геном и отличаются от других β-рецепторов только своей третичной структурой. Они могут присутствовать в тканях (в частности, в сердце), в которых экспрессируются другие β-рецепторы.
В. Рецепторы дофамина
Дофаминергические рецепторы локализованы в ЦНС, пресинаптических окончаниях симпатических нервов, гипофизе, сердце, почках, мезентериальных сосудах и других местах. Известно пять подтипов дофаминергических рецепторов (D1-D5). Рецепторы D1 связывают дофамин с большим сродством, чем галоперидол, тогда как рецепторы D2 — наоборот. Эффекты стимуляции D1-рецепторов, расположенных на постсинаптических мембранах клеток головного мозга, опосредуются активацией аденилатциклазы. В гипофизе же экспрессируются D2-рецепторы, которые ингибируют продукцию цАМФ, открывают калиевые каналы и тормозят поступление кальция в клетки.
Дофамин, секретируемый гипоталамусом, попадает в венозное сплетение, питающее гипофиз, и угнетает секрецию пролактина лактотрофами. Подобно этому, гипофизарную секрецию пролактина ингибируют дофаминергические вещества (такие как каберголин, бромокриптин и перголид).
Регуляция симпатоадреналовой активности
Симпатоадреналовая активность определяется в основном скоростью секреции катехоламинов. Однако более тонкая регуляция этой активности осуществляется на рецепторном и пострецепторном уровнях.
Как отмечено выше, норадреналин и адреналин, выделяющиеся при стимуляции симпатических нервов, связываются с пресинаптическими ос-рецепторами, тормозя дальнейшее выделение норадреналина из нервных окончаний. Вместе с катехоламинами из нейросекреторных гранул выделяется ХгА. Его фрагмент, катестатин, блокирует холинергические рецепторы симпатических нейронов, снижая, тем самым, симпатоадреналовую активность.
Связывание агонистов с адренорецепторами уменьшает число последних на поверхности эффекторных клеток (так называемая «снижающая регуляция»). В отличие от этого, антагонисты катехоламиновых рецепторов не уменьшают их экспрессии на поверхности клеток-мишеней.
Механизмы «снижающей регуляции» отчасти выяснены. Например, фосфорилирование β-рецепторов рецепторной киназой приводит к их секвестрации в мембранных пузырьках, интернализации и распаду. Фосфорилирование рецепторов увеличивает также их сродство к β-аррестину, еще одному регуляторному белку, который препятствует взаимодействию рецептора с Gsα.
Тиреоидные гормоны увеличивают число β-адренорецепторов в миокарде. Эстрогены увеличивают число ос-рецепторов в миометрии, а также повышают сродство некоторых сосудистых ос-рецепторов к норадреналину.
Присутствие адренорецепторов на поверхности большинства клеток организма подчеркивает регуляторное значение периферической симпатической нервной системы. Гормоны же мозгового вещества надпочечников оказывают гораздо более генерализованное влияние. Кроме того, секреция катехоламинов мозговым веществом надпочечников значительно возрастает только при стрессе или резком нарушении гомеостаза.
Эффекты катехоламинов, циркулирующих в крови
Дофамин играет важнейшую роль в качестве центрального нейротрансмиттера и предшественника норадреналина. Однако в крови его концентрация значительно меньше, чем других катехоламинов. Присутствие дофамина в моче обусловлено в основном высокой активностью ДОФА-декарбоксилазы в почках. При повышении уровня дофамина в сыворотке он взаимодействует с сосудистыми α1-рецепторами, вызывая вазодилатацию и увеличение почечного кровотока.
Активация сосудистых а,-рецепторов и сужение сосудов происходит лишь при очень высокой концентрации дофамина в сыворотке.
Норадреналин синтезируется в мозговом веществе надпочечников, симпатических параганглиях, головном мозге и нервных клетках спинного мозга. Однако наибольшее количество норадреналина присутствует в синаптических пузырьках постганглионарных симпатических нервов, иннервирующих сердце, слюнные железы, гладкие мышцы сосудов, печень, селезенку, почки и скелетные мышцы. Один симпатический аксон может образовывать до 25 000 синаптических окончаний; норадреналин синтезируется и запасается в секреторных гранулах каждого нервного окончания, контактирующего с клеткой-мишенью.
Норадреналин активирует α1-адренорецепторы, что увеличивает приток кальция в клетку-мишень. Альфа,-рецепторы присутствуют на сосудах, питающих сердце, расширяющую зрачок мышцу и гладкие
мышцы. Активация α1-адренорецепторов приводит к расширению зрачков, повышению артериального давления, усилению сердечных сокращений и потоотделения из апокринных «стрессовых» потовых желез (не принимающих участия в терморегуляции). Эти железы расположены на ладонях, подмышками и на лбу. Активация β-адренорецепторов норадреналином сопровождается притоком кальция в клетки-мишени. Норадреналин обладает высоким сродством к β1-адренорецепторам и увеличивает силу и частоту сердечных сокращений, противодействуя эффекту одновременной стимуляции блуждающего нерва. Сродство норадреналина к β2-адренорецепторам, опосредующим вазодилатацию и гликогенолиз в печени, существенно меньше; гиперметаболизм и гипергликемия развиваются лишь при высоких концентрациях этого катехоламина. Норадреналин активирует и β3-рецепторы жировых клеток, вызывая липолиз с повышением уровня свободных жирных кислот в сыворотке.
Адреналин также взаимодействует с α1-и β1-адренорецепторами, вызывая те же эффекты, что и норадреналин. Однако адреналин активирует и β2-рецепторы, что приводит к расширению сосудов скелетных мышц. Таким образом, он может вызывать как повышение, так и (редко) снижение артериального давления. Мощным стимулятором мозгового вещества надпочечников является гипогликемия; адреналин усиливает гликогенолиз в печени. Одновременно усиливается и липолиз, возрастает уровень свободных жирных кислот в сыворотке и возрастает основной обмен. Адреналин плохо проникает через гематоэнцефалический барьер, но при высокой концентрации в сыворотке влияет на гипоталамус, вызывая неприятные ощущения (вплоть до страха надвигающейся смерти). Эти эффекты отличаются от действия амфетаминов некатехоламиновой структуры, которые легче проникают в ЦНС и оказывают иные влияния на психику.
Физиологические эффекты
А. Сердечно-сосудистые
Катехоламины (особенно адреналин) повышают частоту и силу сердечных сокращений и увеличивают раздражимость миокарда, действуя в основном через р,-адренорецепторы. Регуляторные влияния катехоламинов на гладкие мышцы сосудов опосредуются преимущественно α1-, α2- и β2-рецепторами. Через а,-рецепторы катехоламины вызывают сокращение этих мышц. Хотя на них присутствуют и β-рецепторы, опосредующие расширение сосудов, более важную роль в механизме вазодилатации играют, по-видимому, другие факторы. Таким образом, при повышении секреции или введении катехоламинов следует ожидать учащения сердцебиений, возрастания минутного объема сердца и сужения периферических сосудов, что приводит к повышению артериального давления. Однако увеличение артериального давления рефлекторно усиливает парасимпатические влияния блуждающего нерва, вследствие чего частота сердцебиений и минутный объем могут снижаться. Эти эффекты особенно характерны для норадреналина, тогда как действие адреналина зависит от исходного тонуса гладких мышц сосудов. При повышенном их тонусе небольшие количества адреналина могут расслаблять эти мышцы, снижая среднее артериальное давление, несмотря на повышение частоты сердечных сокращений и минутного объема сердца. Однако при
исходно сниженном тонусе гладкомышечной оболочки сосудов адреналин повышает среднее артериальное давление. Помимо рефлекторных механизмов, кровоток регулируется ЦНС, и в определенных условиях сосуды одних областей тела могут расширяться, а в других — сохранять свой тонус. Центральная организация симпатической нервной системы предполагает возможность дискретной регуляции просвета сосудов, тогда как стресс генерализованно стимулирует эту систему, приводя к выбросу катехоламинов в кровь. Введение катехоламинов сопровождается быстрым уменьшением объема плазмы, что, вероятно, является приспособительной реакцией на сужение артериального и венозного сосудистого ложа.
Б. Внесосудистые гладкие мышцы
Катехоламины влияют также на гладкие мышцы других тканей, вызывая сокращение (через а,-рецепторы) или расслабление (через β2-рецепторы) матки, расслабление кишечника и мочевого пузыря (через β2-рецепторы), сокращение мочевого пузыря и кишечных сфинктеров (через α2-рецепторы), расслабление трахеи (через β2-рецепторы) и расширение зрачков (через α1-рецепторы).
В. Метаболические эффекты
Катехоламины повышают потребление кислорода и теплопродукцию. Этот эффект опосредуется β1-рецепторами, но его механизм остается неизвестным. Катехоламины стимулируют также мобилизацию запасов глюкозы и жира. Гликогенолиз в сердечной мышце и печени обеспечивает возможность утилизации углеводов. Липолиз в жировой ткани с увеличением уровня свободных жирных кислот и глицерина в крови создает возможность утилизации этих соединений другими органами. Эти метаболические эффекты катехоламинов у человека реализуются через β-рецепторы.
Катехоламины влияют на экскрецию воды, натрия, калия, кальция и фосфата с мочой. Стимуляция β1-рецепторов увеличивает секрецию ренина юкстагломерулярным аппаратом почек, активируя, тем самым, ренин-ангиотензиновую систему. Это приводит к усилению секреции альдостерона. Однако механизмы и значение всех этих сдвигов остаются неясными.
Регуляция секреции других гормонов
Дофамин представляется собой пролактин-ингибирующий гормон; секреция гипоталамических рилизинг гормонов также, по-видимому, контролируется симпатической нервной системой. На периферии симпатическая нервная система (через почечные нервы и катехоламины крови) регулирует секрецию ренина юкстагломерулярным аппаратом почек. Катехоламины усиливают секрецию ренина, действуя через β-рецепторы. На фоне блокады α-адренорецепторов стимуляция β-рецепторов усиливает секрецию инсулина островковыми β-клетками поджелудочной железы. Однако, действуя через α-адренорецепторы, норадреналин или адреналин ингибируют секрецию инсулина. Аналогичные изменения наблюдаются и в секреции глюкагона α-клетками поджелудочной железы. Действуя через β-рецепторы, катехоламины стимулируют секрецию тироксина, кальцитонина, паратгормона и гастрина.
Хромогранин А (ХгА)
Хромогранины представляют собой кислые одноцепочечные гликопротеины, присутствующие в нейросекреторных гранулах. Различают хромогранины А (ХгА), В (секретогранин I) и С (секретогранин II). Ген ХгА у человека расположен на хромосоме 14 и кодирует пептид из 431-445 аминокислотных остатков. При низком рН или высокой концентрации кальция молекулы ХгА образуют агрегаты, которые способствуют формированию секреторных пузырьков и накоплению в них гормонов.
ХгА является, как бы, прогормоном. Эндопептидазы расщепляют его на пептиды меньших
размеров. N-концевые фрагменты ХгА — вазостатин I (ХгА 1-76) и вазостатин II (ХгА 1-115) — препятствуют сужению сосудов. Кроме того, из ХгА образуется катестатин (ХгА 352-372), который блокирует рецепторы ацетилхолина и, тем самым, снижает активность симпатоадреналовой системы.
ХгА вырабатывается не только в мозговом веществе надпочечников, но и вне этих желез — в нейроэндокринных клетках, секретирующих пептидные гормоны. Он обнаруживается в гипофизе, околощитовидных железах, ЦНС и в клетках островков поджелудочной железы.
Адреномедуллин
Адреномедуллин (AM) был впервые выделен из ткани феохромоцитомы, что и послужило причиной ошибочного названия этого вещества. Оно вырабатывается не только в мозговом, но и в корковом веществе надпочечников (в клубочковой зоне), а также во многих других тканях. На самом деле, надпочечники служат лишь минорным источником AM крови. AM (состоящий из 52 аминокислотных остатков) представляет собой продукт расщепления препроадреномедуллина, который кодируется геном, расположенным на хромосоме 11. По своей структуре AM гомологичен кальцитониноподобному пептиду (КПП) и действует как через рецепторы КПП 1-го типа, так и через свои собственные рецепторы. Взаимодействие AM с рецепторами, сопряженными с G-белком, приводит к активации аденилатциклазы и повышению внутриклеточного уровня цАМФ.
Эффекты AM разнообразны. В надпочечниках он, по-видимому, тормозит секрецию альдостерона. AM секретируется также сердечной мышцей, легкими, почками, головным мозгом, а также эндотелием сосудов, вызывая их расширение. Это вещество оказывает и натрийуретическое действие, выделяясь миокардом при застойной сердечной недостаточности. AM стимулирует рост феохромоцитом и многих других опухолей, тормозит апоптоз опухолевых клеток и подавляет иммунные реакции против них.
В ряде тканей присутствует N-концевой фрагмент AM, проадреномедуллин, состоящий из 20 аминокислотных остатков. Этот пептид снижает артериальное давление. Однако его действие обусловлено угнетением передачи нервных импульсов в окончаниях симпатических нервов, а не прямым расслаблением гладких мышц сосудов.
ДРУГИЕ ГОРМОНЫ, СЕКРЕТИРУЕМЫЕ МОЗГОВЫМ ВЕЩЕСТВОМ НАДПОЧЕЧНИКОВ
Хромаффинные клетки мозгового вещества надпочечников и периферические симпатические нейроны синтезируют и секретируют опиоидные пептиды, включая мет- и лей-энкефалин. Эти вещества запасаются в секреторных гранулах вместе с катехоламина-ми. Они присутствуют также в окончаниях волокон, иннервирующих мозговое вещество надпочечников, и могут снижать симпатическую активность.
В мозговом веществе надпочечников вырабатывается и вазопрессин. Здесь же присутствуют и его рецепторы (V1a и V1b), через которые, как полагают, вазопрессин регулирует секрецию катехоламинов. В экстрактах мозгового вещества надпочечников обнаруживается также кортикотропин-рилизинг гормон (КРГ), рилизинг-гормон гормона роста (РГГР), соматостатин и пептид гистидин-метионин. Все эти и другие активные пептиды секретируются опухолями мозгового вещества надпочечников и обусловливают некоторые симптомы таких опухолей, но их функция в норме остается неясной.
